Поміркуйте
За розміщенням Гідрогену в Періодичній таблиці визначте: він є металічним чи неметалічним елементом. Такі хімічні елементи прагнуть віддавати чи приєднувати електрони?
Гідроген — перший хімічний елемент Періодичної таблиці і є неметалічним елементом. Його атоми найпростіші, адже складаються з ядра з найменшим зарядом (+1) та лише одного електрона, тому атом цього хімічного елемента може як віддавати, так і приєднувати електрон.
Поміркуйте
У якому об'ємному співвідношенні слід змішати водень і кисень, щоб усі реактанти прореагували повністю? Відповідь обґрунтуйте.
Запишемо рівняння реакції
2Н2 + О2 = 2Н2О
V(H2) : V(O2) = 2 : 1
За рівнянням реакції водень і кисень слід змішати в об'ємних співвідношеннях 2:1.
Поміркуйте
Як називають продукт цієї реакції?
Продукти реакції водню з лужними і лужноземельними металами називаються гідридами.
Поміркуйте
Вивчаючи § 9, ви дізналися про спосіб одержання кисню електролізом води. Чи можна цей спосіб використовувати для одержання водню?
Під час електролізу води утворюються кисень і водень. Отже, у цей спосіб можна одержувати обидві ці речовини.
Поміркуйте
Проаналізуйте мал. 9.3 на с. 73. Чим можна пояснити різницю об'ємів газів в обох пробірках?
Різницю об'ємів газів в обох пробірках можна пояснити різною кількістю утворених молекул водню та кисню.
Вправа 175
Поясніть, як утворюються йони Гідрогену Н– і Н+.
Атом Гідрогену віддає один електрон і перетворюється на йон (катіон) Гідрогену Н+.
Атом Гідрогену приєднує один електрон і перетворюється на йон (аніон або гідрид–іон) Гідрогену Н–.
Вправа 176
Проаналізуйте рівняння реакцій водню з неметалами. Поясніть умови, за яких відбувається та чи інша реакція. Запишіть назви утворених продуктів реакцій.
Реакції водню з неметалами у більшості випадків відбуваються за певних умов: за нагрівання (t), наявності тиску (p), освітлення (hν), каталізатора (кат.) тощо.
H2 + F2 = 2HF ( за звичайних умов з вибухом). HF – фторид водню.
H2 + Cl2 = 2HCl (hν). HCl – хлорид водню.
2Н2 + О2 = 2Н2О (кат.). H2О – вода.
Н2 + S = H2S (t). H2S – гідроген сульфід.
3H2 + N2 = 2NH3 (t, p, кат.). NH3 – амоніак.
2H2 + C → CH4 (t). CH4 – метан.
Вправа 177
Складіть формули бінарних сполук Гідрогену з: К, Li, Mg, Sr, Al.
| KH | LiH | MgH2 | SrH2 | AlH3 |
Вправа 178
Складіть хімічні рівняння утворення бінарних сполук, згаданих у попередньому завданні, із простих речовин.
2K + H2 = 2KH
2Li + H2 = 2LiH
Mg + H2 = MgH2
Sr + H2 = SrH2
2Al + 3H2 = 2AlH3
Вправа 179
Складіть назви сполук. Для останніх двох речовин складіть рівняння реакцій із воднем.
Fe2O3 – ферум (+3) оксид, CuO – купрум (+2) оксид, WO3 – вольфрам (+3) оксид,
Ag2O – аргентум (+1) оксид, MnO – манган (+2) оксид.
Ag2O + H2 = 2Ag + H2O
MnO + H2 = Mn + H2O
Вправа 180
Останнім часом дедалі більше застосовують промисловий спосіб одержання чистого заліза відновленням ферум (3+) оксиду воднем. Обчисліть об'єм водню (н. у.), який витрачається під час одержання заліза з ферум (3+) оксиду масою 160 кг.
Відомо: m(Fe2O3) = 160 кг = 160000 г
Знайти: V(H2)–?
Розв'язання
Обчислюємо кількість речовини ферум (+3) оксиду.
Mr(Fe2O3) = 2Ar(Fe) + 3Ar(O) = 2 • 56 + 3 • 16 = 160, тому M(Fe2O3)=160 г/моль
n(Fe2O3) = m(Fe2O3):M(Fe2O3) = 160000 г : 160 г/моль = 1000 моль
Записуємо рівняння реакції: Fe2O3 + 3H2 = 2Fe + 3H2O
n(Fe2O3):n(H2)=1:3, тому n(H2)=n(Fe2O3) • 3 : 1 = 1000 моль • 3 : 1 = 3000 моль
Обчислюємо об'єм водню.
V(H2) = n(H2) • Vm = 3000 моль • 22,4 л/моль = 67200 л, або 67,2 м3
Відповідь: витратиться 67,2 м3 водню.
Вправа 181
Реакція цинку з хлоридною кислотою — найпоширеніший спосіб одержання водню в шкільній лабораторії. Обчисліть масу цинку, яка знадобиться для одержання водню об'ємом 5,6 л (н.у.).
Відомо: V(H2) = 5,6 л
Знайти: m(Zn)–?
Розв'язання
Записуємо рівняння реакції: Zn + 2HCl = ZnCl2 + H2
V(Zn):V(H2)=1:1, тому V(Zn)=V(H2) = 5,6 л
Обчислюємо кількість речовини цинку.
n(Zn) = V(Zn) : Vm = 5,6 л : 22,4 л/моль = 0,25 моль
Обчислюємо масу цинку.
M(Zn)=65 г/моль
m(Zn) = n(Zn)• M(Zn) = 0,25 моль • 65 г/моль = 16,25 г
Відповідь: знадобиться 16,25 г цинку.
Вправа 182
У промисловості водень використовують для синтезу метану з вуглецю за високої температури. Обчисліть об'єм водню (н. у.), необхідний для одержання метану масою 44 г.
Відомо: m(CH4) = 44 г
Знайти: V(H2)–?
Розв'язання
Обчислюємо кількість речовини метану.
Mr(CH4)=Ar(C)+4Ar(H)=12+4•1=16, тому M(CH4)=16 г/моль
n(CH4) = m(CH4):M(CH4) = 44 г : 16 г/моль = 2,75 моль
Записуємо рівняння реакції: C + 2H2 = CH4
n(H2):n(CH4)=2:1, тому n(H2)=n(CH4) • 2 : 1 = 2,75 моль • 2 : 1 = 5,5 моль
Обчислюємо об'єм водню.
V(H2) = n(H2) • Vm = 5,5 моль • 22,4 л/моль = 123,2 л
Відповідь: необхідно 123,2 л водню.
Вправа 183
Під час електролізу води одержують водень, який можна використовувати як пальне. Обчисліть масу витраченої води й об'єм утвореного кисню, якщо під час електролізу одержано 2 м3 водню (н.у).
Відомо: V(H2) = 2 м3 = 2000 л
Знайти: m(H2O)–?, V(O2)–?
Розв'язання
Записуємо рівняння реакції: 2H2 + O2 = 2H2O
V(H2):V(O2)=2:1, тому V(O2)=V(H2) • 1 : 2 = 2м3 : 2 • 1 = 1 м3
V(H2):V(H2O)=2:2=1:1, тому V(H2O)=V(H2) = 2000 л
Обчислюємо кількість речовини води.
n(H2O) = V(H2O) : Vm = 2000 л : 22,4 л/моль = 89,27 моль
Обчислюємо масу води.
M(H2O)=18 г/моль
m(H2O) = n(H2O)• M(H2O) = 89,3 моль • 18 г/моль = 1607 г ≈ 1,6 кг
Відповідь: витратиться 1,6 кг води і утвориться 1 м3 кисню.
Вправа 184
Амоніак — дуже важлива промислова речовина, він є сировиною для одержання азотних добрив. Обчисліть об'єм водню (н. у.), необхідний для одержання амоніаку масою 340 кг.
Відомо: m(NH3) = 340 кг = 340000 г
Знайти: V(H2)–?
Розв'язання
Обчислюємо кількість речовини амоніаку.
Mr(NH3)=Ar(N)+3Ar(H)=14+3•1=17, тому M(NH3)=17 г/моль
n(NH3) = m(NH3):M(NH3) = 340000 г : 17 г/моль = 20000 моль
Записуємо рівняння реакції: N2 + 3H2 = 2NH3
n(H2):n(NH3)=3:2, тому n(H2)=n(NH3) • 3 : 2 = 20000 моль • 3 : 2 = 30000 моль
Обчислюємо об'єм водню.
V(H2) = n(H2) • Vm = 30000 моль • 22,4 л/моль = 672000 л = 672 м3
Відповідь: необхідно 672 м3 водню.
Вправа 185
Деякі метали, зокрема хром, використовують для захисту сталі від корозії (іржавіння). Обчисліть масу хром (3+) оксиду, який можна відновити, використовуючи водень об'ємом 44,8 л (н. у.). Обчисліть масу утвореного хрому.
Відомо: V(H2) = 44,8 л
Знайти: m(Cr2O3)–?, m(Cr)–?
Розв'язання
Обчислюємо кількість речовини водню.
n(H2) = V(H2) : Vm = 44,8 л : 22,4 л/моль = 2 моль
Записуємо рівняння реакції: Cr2O3 + 3H2 = 2Cr + 3H2O
n(Cr2O3):n(H2)=1:3, тому n(Cr2O3)=n(H2) • 1 : 3 = 2 моль • 1 : 3 = 0,67 моль
n(H2):n(Cr)=3:2, тому n(Cr)=n(H2) • 2 : 3 = 2 моль • 2 : 3 = 1,33 моль
Обчислюємо масу хром (+3) оксиду і хрому.
M(Cr2O3)=152 г/моль, M(Cr)=52 г/моль
m(Cr2O3) = n(Cr2O3)• M(Cr2O3) = 0,67 моль • 152 г/моль ≈ 102 г
m(Cr) = n(Cr)• M(Cr) = 1,33 моль • 52 г/моль ≈ 69,2 г
Відповідь: можна відновити 102 г хром (3+) оксиду з утворенням 69,2 г хрому.
Вправа 186
Зважаючи на процеси, які відбуваються в апараті Кіппа, спрогнозуйте: водень, який виділяється з нього, є вологим чи сухим (без домішок водяної пари)?
У апараті Кіппа водень отримують під час реакції твердого цинку з розчином соляної кислоти, тому утворений водень проходить крізь розчин, насичуючись парами води, і містить домішки водяної пари, яка робить його вологим.
Вправа 187
Проаналізуйте хімічні властивості водню та способи його одержання, описані в параграфі. До якого типу належить кожна з реакцій? Поясніть свою відповідь.
Реакція одержання водню гідролізом води належить до реакції розкладу, адже в результаті реакції з одної складної речовини води H2O утворюються дві речовини: водень H2 i кисень O2.
H2O = H2↑ + O2↑
Реакції одержання водню шляхом взаємодії металів з кислотами і відновлення металів з оксидів належить до реакцій заміщення, адже атоми простої речовини заміщують атоми іншої речовини у складі складної речовини.
Одержання водню в лабораторії.
Zn + 2НСl = ZnCl2 + Н2↑ Атом Цинку заміщує атоми Гідрогену в складі кислоти.
Відновлення металів з оксидів.
Fe2O3 + 3H2 = 2Fe + 3H2O Атоми Гідрогену заміщують атоми Феруму в оксиді.
Вправа 188
Водень легко відновлює мідь із купрум (2+) оксиду за нагрівання. Під час цієї реакції утворюється мідь, оскільки вона вже не здатна реагувати з воднем. Як ви вважаєте, чи можливо здійснити реакцію одержання натрію під час взаємодії натрій оксиду з воднем?
Ні, неможливо одержати натрій у такий спосіб, адже натрій реагує з водою, утворюючи луги.
Вправа 189
Пригадайте, які реакції називають окисненням (за §10). Проаналізуйте схеми, на яких проілюстровано два хімічні процеси. Сформулюйте гіпотезу, чому реакції окиснення та відновлення називають протилежними процесами. Відповідь обґрунтуйте.
Реакції окиснення та відновлення називають протилежними процесами, бо реакція окиснення є процесом віддавання електронів, а реакція відновлення є процесом приєднання тих самих електронів, причому ці два процеси відбуваються одночасно в хімічних реакціях.
Вправа 190
Зважаючи на хімічні властивості та способи одержання водню, описані в параграфі, спрогнозуйте, як можна використовувати водень у науці й техніці.
Водень використовують для одержання хлоридної кислоти і амоніаку, під час різання і зварки металів, для отримання чистих металів, а також в якості пального.
Вправа 191
Проаналізуйте гравюру зі старого підручника хімії. На ній зображено дослід із доведення факту, що під час згоряння водню утворюється вода. Схарактеризуйте значення кожної частини приладу та процеси, які в них відбуваються.
Прилад складається з резервуару для водню, камери згоряння та конденсатора.
Водень з резервуару потрапляє в камеру згоряння, де у разі підпалювання або за наявності каталізатора, активно реагує з киснем повітря і утворює воду з виділенням великою кількості теплоти, яка у вигляді водяної пари потрапляє до конденсатора, з якого краплями стікає в ємність для збирання води.

Вправа 192
«Кресало Деберейнера» — один із перших пристроїв для отримання вогню в домашніх умовах, що набув популярності близько 200 років тому. Певною мірою це була перша у світі запальничка. Схематично цей пристрій зображено на малюнку. Проаналізуйте його і поясніть принцип дії цього кресала.
«Кресало Деберейнера» — це пристрій для отримання вогню, який працює на основі хімічної реакції між цинком та кислотою, внаслідок якої виділяється водень, що самозаймається на повітрі в присутності платини (каталітично окиснюється).
Коли користувач натискає на клапан (е), цинковий циліндр (d), опускається у склянку з кислотою (a), де цинк контактує з кислотою і відбувається реакція з утворенням водню, який по трубці через форсунку (f) потрапляє на платинову спіраль (g), де контактує з платиною (відіграє роль каталізатора), що призводить до самозаймання водню при контакті з киснем повітря, внаслідок чого виникає постійне полум'я, яким користуються для запалювання. Після відпускання клапана (е) горіння припиняється.
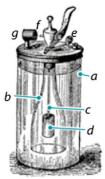 |
а — склянка з кислотою;
b — бутель без дна;
с — стержень;
d — цинковий циліндр;
е — клапан;
f — форсунка;
g — платинова спіраль.
|
Вправа 193
Визначення формули води та деяких простих речовин, на кшталт водню й хлору, відбулося не одразу. Близько 200 років тому склад молекул згаданих речовин записували як OH, Н, Сl відповідно. Лише після відкриття 1811 року свого газового закону (який учні й учениці іноді називають законом «трьох однакових»), Амедео Авоґадро встановив правильні формули цих речовин — Н2О, Н2 і Сl2. Визначте правильність тверджень, які могли б допомогти Авоґадро дійти правильних висновків.
I. Якби молекули водню й хлору були одноатомними, то внаслідок реакції H2 + Cl2 = 2HCl відбувалося б зменшення об'єму початкової суміші газів.
Рівняння реакції мало би вигляд: H + Cl = HCl 1V + 1V = 1V, отже, з 2V—>1V, тому об’єм суміші зменшиться.
II. Якщо реакцію утворення гідроген хлориду записати як Н2 + Сl2 = 2НСl, то цим пояснюється відсутність зміни об'єму суміші газів.
Рівняння реакції: H2 + Cl2 = 2HCl 1V + 1V = 2V, отже, з 2V—>2V, тому об’єм суміші не зміниться.
III. Якщо формула води Н2O, то під час взаємодії водню з киснем об'єм суміші газів має зменшитися на третину.
Рівняння реакції: 2H2 + O2 = 2H2O 2V + 1V = 2V, отже, з 3V—>2V, V—>(2/3)V, тому об’єм суміші зменшиться на третину (1–2/3=1/3).
Навчальне дослідження № 5
«Досліджуємо водень»
Обладнання: апарат Кіппа, кристалізатор із водою, соломинка, пробірки, сірники.
Речовини: цинк, хлоридна кислота, мильний розчин.
I Досліджуємо роботу апарата Кіппа.
Ознайомтеся з улаштуванням апарата Кіппа.
Якщо відкрити кран газовідвідної трубки та спостерігаємо появу бульбашок.
Якщо закрити кран, то бульбашки перестають появлятися.
II Досліджуємо фізичні властивості водню.
Поміркуйте
Сформулюйте гіпотезу як довести, що густина водню менша за густину повітря.
Якщо мильні бульбашки, наповнені воднем, будуть здійматися догори, значить густина водню менша за густину повітря.
Відкрийте кран газовідвідної трубки апарата Кіппа, а газовідвідну трубку занурте в кристалізатор, наповнений мильним розчином. Що ви спостерігаєте?
Бульбашки, що появляються, здіймаються догори.
Для порівняння запропонуйте одному / одній із вас продмухувати повітря з легень соломиною крізь такий самий мильний розчин.
Результат буде однаковий. Бульбашки, що появляються, будуть здійматися догори.
III Збираємо водень
Поміркуйте
Зважаючи на відомі вам способи збирання газів, сформулюйте гіпотезу: у який спосіб можна збирати водень.
Оскільки водень малорозчинний у воді і не реагує з нею, то його можна збирати методом витісненням води.
Оскільки водень легший за повітря, то пробірку треба тримати отвором униз, збираючи його способом витісненням повітря.
IV Перевірте наявність водню.
Сформулюйте гіпотезу: у який спосіб можна довести наявність водню в пробірці.
Оскільки водень згоряє з характерним хлопком, то для його доведення достатньо піднести до отвору пробірки запалений сірник (запальничку).
Підбиваємо підсумки
1 За якою ознакою можна стверджувати, що реакція в апараті Кіппа відбувається?
Утворюються бульбашки газу.
2 Апарат Кіппа — зручний прилад для одержання в ньому різних газів, а не лише водню, у лабораторії. Зручність насамперед полягає в тому, що апарат легко перемикається із зарядженого стану в робочий і навпаки лише поворотом крана на газовідвідній трубці. Поясніть:
а) як апарат Кіппа переходить у робочий стан після відкриття крана;
Кислота з верхнього резервуару стікає в середній, де контактує з цинком, і починається реакція.
б) як апарат переходить у заряджений стан після закриття крана.
Тиск газу витісняє кислоту вгору у верхній резервуар, реакція припиняється.
3 Унаслідок якого процесу кислота з верхнього резервуара потрапляє в середній після відкриття крана?
Під дією атмосферного тиску.
4 Унаслідок яких фізичних процесів кислота піднімається у верхній резервуар після закриття крана?
Тиск газу тисне на рідину, витісняючи кислоту вгору у верхній резервуар.
5 Як результати дослідження (дослід II) доводять різницю густин водню та повітря?
Мильні бульбашки, наповнені воднем, здіймаються вгору.
6 На яких фізичних процесах ґрунтуються способи збирання водню витісненням води та витісненням повітря?
Водень малорозчинний у воді, тому його збирають способом витіснення води. Густина водню менша за густину повітря, тому пробірку тримають отвором униз, збираючи водень способом витісненням повітря.
7 На чому ґрунтується спосіб виявлення водню?
На здатності водню горіти в суміші з повітрям чутним звуком — хлопком.
8 На чому ґрунтується спосіб визначення чистоти зібраного водню?
На здатності чистого водню горіти без чутного звуку.