Поміркуйте
Сформулюйте гіпотезу: чому в апараті Кіппа незручно використовувати крейду. Для формулювання припущення згадайте, що відбувається з крейдою в разі тривалого контакту з водою.
За звичайних умов крейда в разі тривалого контакту з водою утворює суспензію, що може впливати на протікання реакції в апараті Кіппа, адже подрібнені частинки крейди можуть, наприклад, забити газовідвідну трубку апарата Кіппа, тому її незручно використовувати.
Cуспензія — неоднорідна суміш рідини з твердими частинками, що перебувають в завислому стані.
Пригадайте
До якого типу оксидів належить карбон (ІV) оксид. Чи взаємодіє він із водою?
Карбон (ІV) оксид належить до кислотних оксидів.
Чи взаємодіє він із водою?
Під час контакту з водою він розчиняється і певна його частка реагує з водою з утворенням нестійкої карбонатної кислоти H2CO3.
Рівняння реакції: СO2 + Н2О = Н2СО3
Поміркуйте
Сформулюйте гіпотезу: як можна довести наявність карбонатної кислоти у водному розчині вуглекислого газу. Запропонуйте план дослідження.
Гіпотеза. Якщо у водному розчині вуглекислого газу утворюється карбонатна кислота, тоді індикатор в цьому розчині повинен набувати певного кольору, що відповідає кислому середовищу.
План дослідження:
1. Пропустити вуглекислий газ через дистильовану воду, щоб одержати карбонатну кислоту — водний розчин вуглекислого газу.
2. Додати до розчину кілька крапель індикатора, наприклад, лакмусу.
3. Спостерігати зміну забарвлення індикатора на червоний колір.
Зробити висновок про наявність карбонатної кислоти в розчині.
Пригадайте
Які речовини називають лугами? Лугами називають розчинні у воді основи.
Вправа 227
Підготуйте ілюстровану доповідь про відкриття та дослідження вуглекислого газу. Чи можна стверджувати, що вуглекислий газ був першою газуватою речовиною, яку почали комерційно застосовувати?
Вуглекислий газ був відкритий у 1754 році шотландцем Джозефом Блеком (1728–1799). Він детально вивчав цей газ і назвав його зв'язаним повітрям, оскільки він поглинався концентрованими лугами та вапном. Прожарюючи вапняк і магнезію, виявив що відбувається виділення великої кількості зв'язаного повітря (вуглекислого газу), що важче за повітря і не підтримує горіння.
Джозеф Прістлі був першим, хто спеціально розчинив вуглекислий газ у воді. Спостерігаючи за роботою місцевої пивоварні, зацікавився бульбашками, які виділялися під час варіння пива і спробував зібрати їх в наповнені водою ємності, які розмістив над чанами. Був вражений смаком такої води.
Так була винайдена газована (содова) вода. На відміну від наявних в той час напоїв (пиво, квас, мінеральні води), які насичувалися вуглекислим газом в процесі бродіння або в природних умовах, Прістлі запропонував напої зі штучним (примусовим) насиченням газу, винайшовши апарат для отримання газованої води. Содова вода стала першим товарним продуктом. Тому вуглекислий газ став першою газуватою речовиною, що стали комерційно застосовувати.
Вправа 228
Порівняйте розчинність кисню з розчинністю вуглекислого газу. У якого газу максимальна масова частка в розчині більша?
Вуглекислий газ (CO2) розчиняється у воді краще, ніж кисень (O2). Більшу розчинність вуглекислого газу можна пояснити тим, що цей газ під час розчинення реагує з водою, утворюючи слабку кислоту. За температури 0°С розчинність на 1 л води вуглекислого газу становить 1,73 г, а кисню — 0,014 г, тому максимальна масова частка вуглекислого газу у воді більша, ніж кисню за однакових умов.
Вправа 229
Обчисліть максимальний об'єм вуглекислого газу, який розчиняється у воді об'ємом 1 л (н.у.). Порівняйте його з розчинністю за 25 °С, якщо густина вуглекислого газу за такої температури 1,8 г/л.
Дано: V(H2O) = 1 л, за н.у. ρ1(CO2)=1,977 г/л, при 25°С ρ2(CO2)=1,8 г/л,
у 1 л води при 0°С (н.у.) розчиняється m1(CO2)=1,73 г, при 25°С — m2(CO2)=1,45 г.
Розв'язання
Обчислюємо об'єм вуглекислого газу за н.у. (0°С) і при 25°С.
V1(CO2) = 1,73 г : 1,977 г/л ≈ 0,875 л
V2(CO2) = 1,45 г : 1,8 г/л ≈ 0,806 л
V2(CO2) = 1,45 г : 1,8 г/л ≈ 0,806 л
0,875 > 0,806.
Отже, з підвищенням температури розчинність зменшується.
Отже, з підвищенням температури розчинність зменшується.
Вправа 230
Запишіть хімічні рівняння реакцій горіння етану С2Н6 та пропану С3Н8 (вуглеводнів, які містяться в природному газі), якщо продукти цих реакцій такі самі, як і під час згоряння метану.
| 2C2H6 + 7O2 = 4CO2 + 6H2O | C3H8 + 5O2 = 3CO2 + 4H2O |
Вправа 231
Складіть назву кальцинованої соди за систематичною номенклатурою.
Na2CO3 — карбонат натрію
Вправа 232
Запишіть хімічні рівняння реакцій вуглекислого газу з магній оксидом, натрій оксидом, натрій гідроксидом, калій гідроксидом, барій гідроксидом.
CO2 + MgO = MgCO3
CO2 + Na2O = Na2CO3
CO2 + 2NaOH = Na2CO3 + H2O
CO2 + 2KOH = K2CO3 + H2O
CO2 + Ba(OH)2 = BaCO3 + H2O
Вправа 233
На цукрових заводах для очищення цукрового екстракту використовують вуглекислий газ, який одержують прожарюванням кальцій карбонату. Обчисліть масу солі, необхідної для одержання вуглекислого газу об'ємом 1,12 м3 (н.у.).
Дано: V(CO2) = 1,12 м3 = 1120 л
Знайти: m(CaCO3)–?
Розв'язання
Обчислюємо кількість речовини вуглекислого газу:
n(CO2) = V(CO2) : Vm = 1120 л : 22,4 л/моль = 50 моль
Записуємо рівняння реакції: CaCO3 = CaO + CO2↑
За рівнянням реакції: n(CaCO3)/n(CO2)=1/1, тому n(CaCO3) = n(СO2)= 50 моль
Обчислюємо масу кальцій карбонату.
За рівнянням реакції: n(CaCO3)/n(CO2)=1/1, тому n(CaCO3) = n(СO2)= 50 моль
Обчислюємо масу кальцій карбонату.
M(CaCO3) = 100 г/моль
m(CaCO3) = n(CaCO3) • M(CaCO3) = 50 моль • 100 г/моль = 5000 г = 5 кг.
m(CaCO3) = n(CaCO3) • M(CaCO3) = 50 моль • 100 г/моль = 5000 г = 5 кг.
Відповідь: 5 кг кальцій карбонату.
Вправа 234
Харчову (питну) соду часто використовують як розпушувач для випікання тістечок. Але перед додаванням до тіста соду «гасять» оцтом. Умовно припустивши, що гасити соду можна й хлоридною кислотою, обчисліть масу гідроген хлориду, який витрачається для гасіння харчової соди масою 10 г. Обчисліть об'єм утвореного вуглекислого газу (н.у.).
Дано: m(NaHCO3) = 10 г
Знайти: m(HCl)–?
Розв'язання
Обчислюємо кількість речовини харчової соди.
М(NaHCO3) = 84 г/моль
n(NaHCO3) = 10 г : 84 г/моль = 0,119 моль
n(NaHCO3) = 10 г : 84 г/моль = 0,119 моль
Записуємо рівняння реакції: NaHCO3 + HCl = NaCl + H2O + CO2↑
За рівнянням реакції n(NaHCO3):n(HCl):n(CO2)=1:1:1, тому
n(HCl) = n(CO2) = n(NaHCO3) = 0,119 моль
Обчислюємо масу гідроген хлориду.
M(HCl) = 36,5 г/моль
m(HCl) = n(HCl) : M(HCl) = 0,119 моль • 36,5 г/моль = 4,34 г.
Обчислюємо об’єм вуглекислого газу.
Обчислюємо об’єм вуглекислого газу.
V(CO2) = n(CO2) • Vn = 0,119 моль • 22,4 л/моль = 2,67 л.
Відповідь: потрібно 4,34 г HCl, при цьому утворюється 2,67 л CO2.
Відповідь: потрібно 4,34 г HCl, при цьому утворюється 2,67 л CO2.
Вправа 235
Для очищення повітря закритих приміщень від вуглекислого газу, повітря можна пропускати крізь патрони з гашеним вапном — кальцій гідроксидом. У повітрі певного приміщення об'ємом 45 м3 (н.у.) накопичився вуглекислий газ до 0,056 % (за об'ємом). Обчисліть масу кальцій гідроксиду, необхідного для повного поглинання такого обсягу вуглекислого газу.
Дано: V(повітря) = 45 м3 = 45000 л; φ(CO2)=0,056%
Знайти: m(Ca(OH)2)–?
Обчислюємо об’єм вуглекислого газу в приміщенні.
V(CO2) = V(повітря) • φ(CO2) : 100% = 45000 л • 0,056% : 100% = 25,2 л
Обчислюємо кількість речовини вуглекислого газу.
n(CO2) = V(CO2) : Vm = 25,2 л : 22,4 л = 1,125 моль
Записуємо рівняння реакції: Ca(OH)2 + CO2 = CaCO3↓ + H2O
За рівнянням реакції n(Ca(OH)2)/n(CO2)=1/1, тому n(Ca(OH)2) = n(CO2) = 1,125 моль
Обчислюємо масу кальцій гідроксиду.
Обчислюємо масу кальцій гідроксиду.
M(Ca(OH)2)=74 г/моль
m(Ca(OH)2) = n(Ca(OH)2) • M(Ca(OH)2) = 1,125 моль • 74 г/моль = 83,25 г
Відповідь: потрібно 83,25 г кальцій гідроксиду.
Вправа 236
Одна людина впродовж доби під час дихання виділяє близько 1 кг вуглекислого газу. Обчисліть масу кальцій оксиду, потрібного для повного поглинання такого обсягу газу.
Дано: m(CO2) = 1 кг = 1000 г
Знайти: m(CaO)–?
Розв'язання
Обчислюємо кількість речовини вуглекислого газу.
M(CO2) = 44 г/моль
n(CO2) = m(CO2):M(CO2) = 1000 г : 44 г/моль = 22,73 моль
Записуємо рівняння реакції: CaO + CO2 = CaCO3
За рівнянням реакції n(CaO)/n(CO2)=1/1, тому n(CaO) = n(CO2) = 22,73 моль
Обчислюємо масу кальцій оксиду.
За рівнянням реакції n(CaO)/n(CO2)=1/1, тому n(CaO) = n(CO2) = 22,73 моль
Обчислюємо масу кальцій оксиду.
M(CaO) = 56 г/моль
m(CaO) = n(CaO) • M(CaO) = 22,73 г • 56 г/моль = 1272,88 г ≈ 1,27 кг.
Відповідь: потрібно 1,27 кг кальцій оксиду.
Вправа 237
До зубної пасти часто додають кальцій карбонат (крейду), який сприяє кращому очищенню зубів. Але з цією метою не можна використовувати природну крейду, оскільки під час її подрібнення утворюються часточки з гострими краями, які можуть пошкодити зубну емаль. Крейду для додавання до зубної пасти синтезують із кальцій гідроксиду, отримуючи сферичні часточки. Для синтезу кальцій карбонату спочатку спалили метан об'ємом 560 л (н.у.), а одержаний вуглекислий газ пропустили крізь достатню кількість розчину кальцій гідроксиду. Обчисліть масу одержаного кальцій карбонату.
Дано: V(CH4) = 560 л
Знайти: m(CaCO3)-?
Розв'язання
Обчислюємо кількість речовини метану.
n(CH4) = V(CH4) : Vm = 560 л : 22,4 л/моль = 25 моль
Записуємо рівняння реакції горіння метану: CH4 + 2O2 = CO2 + 2H2O
За рівнянням реакції n(CH4)/n(CO2)=1/1, тому n(CO2)=n(CH4)=25 моль
Записуємо рівняння реакції одержання карбонату: CO2 + Ca(OH)2 = CaCO3 + H2O
За рівнянням реакції n(CO2)/n(CaCO3)=1/1, тому n(CaCO3)=n(CO2)=25 моль
Обчислюємо масу кальцій карбонату:
M(CaCO3) = 100 г/моль
m(CaCO3) = n(CaCO3) • M(CaCO3) = 25 моль • 100 г/моль = 2500 г = 2,5 кг
Відповідь: одержано 2,5 кг кальцій карбонату.
Вправа 238
Порівняйте промислові та лабораторні способи одержання вуглекислого газу. Чи можна ці лабораторні способи застосовувати в промисловості, а промислові — в лабораторній практиці?
У промисловості вуглекислий газ у великих масштабах одержують шляхом спалювання карбоновмісних речовин (вугілля, сажа, метан) чи розкладу карбоновмісних солей (кальцій карбонат). У лабораторії найчастіше невеликими об'ємами вуглекислий газ одержують реакціями взаємодії карбонатів з кислотами.
Ці два способи добування вуглекислого газу відрізняються вихідною сировиною і безпосередньо процесами отримання газу.
У промисловості процес спалювання великих об'ємів речовин вимагає наявності відповідного устаткування, а процес розкладу — наявності високої температури для плавлення карбонатів. Використовуються доступні і великі об'єми вихідних речовин, які наявні в природі.
У лабораторних умовах реакції проводять в апараті Кіппа з невеликими порціями реактантів без нагрівання, причому деякі з них, наприклад, кислоти, попередньо добуваються в процесі хімічних реакцій.
Вправа 239
Звичайна газована вода в пляшках — це розчин вуглекислого газу у воді. Чи можна газовану воду назвати розчином карбонатної кислоти? Чи можна газовану воду використати для одержання вуглекислого газу в невеликих кількостях? Відповіді поясніть.
Газовану воду можна назвати слабким розчином карбонатної кислоти, оскільки вона є водним розчином вуглекислого газу СO2, який утворює карбонатну (вугільну) кислоту H2CO3.
Газовану воду можна використати для одержання вуглекислого газу в невеликих кількостях. Карбонатна кислота, що в ній міститься, є нестійкою і вже за звичайних умов розкладається на воду й вуглекислий газ CO2. Процес розкладу можна пришвидшити струшуванням пляшки або нагріванням такої води.
Вправа 240
Порівняйте процес одержання вуглекислого газу розкладанням кальцій карбонату та реакцією карбон (ІV) оксиду з негашеним вапном. Що в них спільного та відмінного? Як би ви назвали таку пару реакцій?
CaCO3 = CaO + CO2 і CO2 + CaO = CaCO3
Спільним є те, що усі реактанти (реагенти) і продукти реакції є сполуками Карбону.
Відмінним є те, що ці процеси є оборотними (взаємно оберненими), адже є реакціями розкладу і сполучення (утворення) одних й тих речовин, що супроводжуються виділенням і поглинанням теплоти, тобто є екзотермічною і ендотермічною реакціями.
Вправа 241
Запропонуйте, з якою метою можна застосовувати сухий лід.
Сухий лід можна застосовувати для охолодження харчових продуктів при їх транспортуванні та зберіганні без використання холодильних установок, для транспортування медичних препаратів та біологічних зразків, для запобігання таненню крижаних скульптур чи створення сценічних ефектів "туману" під час вистав.
Вправа 242
Зважаючи на фізичні властивості вуглекислого газу припустіть, як застосовують вуглекислий газ у промисловості та техніці.
Застосування вуглекислого газу:
— у харчовій промисловості для газування напоїв завдяки розчинності у воді з утворенням карбонатної кислоти; зберігання продуктів завдяки низькій температурі в твердому стані (сухий лід);
— у медицині та фармації для зберігання ліків і препаратів завдяки низькій температурі в твердому стані (сухий лід);
— у засобах для гасіння пожеж, адже є важчим за повітря, не підтримує горіння;
— у металургії під час зварювання, запобігаючи окисненню;
— у тепличному господарстві для прискорення росту та достигання ранніх овочів шляхом пришвидшення фотосинтезу;
— у хімічній промисловості як сировину для синтезу сечовини, карбонатів тощо.
Вправа 243
Вуглекислий газ — важлива речовина для систем пожежогасіння, зокрема деяких вогнегасників. На малюнку зображені вуглекислотний і повітряно–пінний вогнегасники. Проаналізуйте їхню будову та дайте відповіді на запитання.
• Поясніть значення вуглекислого газу для пожежогасіння, зважаючи на трикутник вогню.
Вуглекислий газ перекриває доступ повітря і охолоджує горючу речовину.
• Опишіть принцип дії вуглекислотного вогнегасника.
Із відкриттям вентиля скраплений під тиском вуглекислий газ різко випаровується, охолоджується і переходить в газоподібний стан у вигляді "снігу", що надходить у зону горіння та перекриває доступ кисню і охолоджує горючу речовину.
• За інструкцією до вуглекислотного вогнегасника під час користування ним у жодному разі не можна триматися руками за патрубок. Поясніть цю вимогу.
Не можна триматися руками за патрубок, бо при випусканні вогнегасної речовини він охолоджується до надзвичайно низьких температур, що може спричинити обмороження шкіри голих ділянок рук.
• Опишіть принцип дії повітряно–пінного вогнегасника.
Принцип дії повітряно-пінного вогнегасника ґрунтується на змішуванні розчину соди з піноутворювачем та кислоти з колби, що розбивається, в момент активації пристрою. У результаті хімічної реакції виділяється велика кількість вуглекислого газу, який разом із піноутворювачем утворює густу піну. Ця піна під тиском викидається назовні, вкриває поверхню, що горить, і припиняє доступ повітря (кисню) та охолоджує верхній шар горючої речовини.
• Яка функція піноутворювача в повітряно–пінному вогнегаснику?
Піноутворювач у вогнегаснику необхідний для створення стійкої піни, яка перекриває доступ кисню до осередку займання та охолоджує гарячу поверхню.
Вправа 244
У необроблених кавових зернах доволі великий уміст кофеїну, що може негативно впливати на організм. Для видалення (повного або часткового) кофеїну із зерен кави їх потрібно додатково обробити перед смаженням. Це, по–перше, позбавить шанувальників кави надлишку кофеїну. А по–друге — у такий спосіб одержують чистий кофеїн для фармацевтичної та харчової промисловості. Проаналізуйте опис процесу декофеїнізації та дайте відповіді на запитання.
Для видалення кофеїну сирі зерна змішують зі скрапленим вуглекислим газом. На відміну від води, кофеїн добре розчиняється в такій рідині. Отриманий розчин відділяють від зерен. Після цього фільтрат поступово приводять до атмосферного тиску, одержуючи практично чистий кристалічний кофеїн. Вуглекислий газ після цього знову скраплюють і використовують для оброблення наступних порцій зерен.
• Які фізичні явища відбуваються під час декофеїнізації?
Екстракція (розчинення) кофеїну в рідкому вуглекислому газі, зміна тиску (декомпресія), кристалізація кофеїну, скраплення вуглекислого газу.
• Які способи розділення сумішей застосовують?
Фільтрування (отримання зерен з розчину), випарювання (відділення кофеїну з розчину).
• У додаткових джерелах знайдіть інформацію, у яких ще галузях з подібною метою використовують скраплений вуглекислий газ.
Скраплений вуглекислий газ з подібною метою використовується в:
— фармацевтичній галузі для екстракції (вилучення) біологічно активних речовин;
— харчовій галузі для отримання ароматів, олій, кофеїну;
— парфумерній галузі для отримання витяжки ароматів;
— екологічній галузі для очищення ґрунтів й води.
Вправа 245
Йохан Баптіст ван Гельмонт ще у XVIII столітті припустив існування вуглекислого газу. Він назвав його spiritus sylvestre («лісовий дух»), порівнявши масу золи з масою спаленої деревини. Чому, на вашу думку, він саме так назвав вуглекислий газ? У XVIII столітті вуглекислий газ також називали «повітря, що фіксується». Зважаючи на хімічні властивості вуглекислого газу, поясніть і цю назву.
Ван Гельмонт назвав вуглекислий газ «лісовим духом», бо він утворювався під час спалювання деревини, яка мала більшу масу в порівнянні з утвореним твердим залишком — золою, «вивільняючись» з дерева, як невидимий дух. Назва «повітря, що фіксується» пов’язана з тим, що вуглекислий газ може поглинатися деякими речовинами, наприклад, лугами чи вапном, утворюючи тверді продукти — карбонати.
Вправа 246
Учні та учениці досліджували реакцію натрій карбонату з хлоридною кислотою. Для цього в посудину насипали надлишок соди й додали певний об'єм кислоти. Після змішування реактантів вони щохвилини вимірювали об'єм виділеного газу й отримані результати зафіксували в таблиці. Проаналізуйте таблицю та дайте відповіді на запитання.
• Запропонуйте схему приладу для цього експерименту.
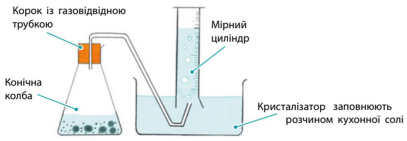
• За який час прореагувала вся кислота? За 5 хвилин.
• Учні й учениці вирішили повторити експеримент, але за вищої температури. Які змінні тепер вони мають контролювати в цьому експерименті? Час і виділений об'єм.
• Більше чи менше газу буде зібрано в другому експерименті? Відповідь поясніть.
Однаковий об'єм газу буде зібрано. Температура впливає на швидкість протікання реакції.
• Припустіть, менший чи більший час знадобиться, щоб витратилася вся кислота. Відповідь поясніть. Запропонуйте спосіб, у який можна перевірити це припущення. Менший час знадобиться, щоб витратилася вся кислота, бо підвищення температури пришвидшить реакцію. Це припущення можна перевірити, порівнюючи зафіксовані значення в таблиці і отримані результати.
Вправа 247
Учні й учениці досліджували способи виявлення вуглекислого газу та зібрали прилад, зображений на малюнку.
• Опишіть призначення кожного елемента цього приладу.
Свічка — це джерело вогню;
лійка — використовується для збирання газуватих продуктів згоряння;
склянка з холодною водою — призначена для охолодження гарячих газів та конденсації водяної пари;
U-подібна трубка — з'єднуючи частини приладу, спрямовує газовий потік;
газовідвідна трубка — газ по ній надходить до пробірки;
пробірка з вапняною водою — використовується для підтвердження (якісної реакції) вуглекислого газу.
• Після запалення свічки учні й учениці очікували на швидке помутніння вапняної води, проте виявилося, що прилад не працює. Поясніть, у чому було припущено помилку в конструкції цього приладу.
У конструкції цього пристрою не вистачає насосу для відкачування повітря, бо прилад містить рідину в пробірці, а природного тиску теплих продуктів згоряння недостатньо, щоб подолати гідростатичний тиск шару вапняної води та пройти крізь неї.
• Як можна змінити конструкцію приладу, щоб він запрацював?
Перевірити герметичність усіх з’єднань та приєднати до кінця газовідвідної трубки (чи додаткового отвору) насос для відкачування повітря.
Вправа 248
Артем, Сніжана та Юля вирішили виміряти молярний об'єм вуглекислого газу. Кожен із них наповнював конічну колбу об'ємом 1,00 л вуглекислим газом з апарата Кіппа та зважував колбу до та після наповнення.
• Навіщо в цей прилад додали осушувач? Чи може вплинути на результати експерименту його відсутність?
Осушувач додали для видалення водяної пари з вуглекислого газу, добутого в апараті Кіппа, бо одержаний газ є вологим, адже проходить крізь водний розчин кислоти. Результати без застосування осушувача будуть помилковими, адже вода вважається домішкою в складі вуглекислого газу, маса якої збільшить масу вуглекислого газу, що вплине на розрахунок густини й на значення одержаного молярного об'єму.
• Якої помилки припустився Артем?
Артем, збираючи вуглекислий газ, не переконався за допомогою запаленої свічки, що зібраний газ повністю заповнив колбу.
• Порівняйте густину вуглекислого газу, отриману Сніжаною, із довідниковою. Чому дані не збігаються? У чому припустилася помилки Сніжана?
Густина, отримана Сніжаною, дорівнює 0,60 г/л, а довідникова густина дорівнює 1,83 г/л, що є майже втричі більшою. Дані не збігаються, бо Сніжана неправильно визначила масу вуглекислого газу. Припустилася помилки, що не врахувала масу повітря в колбі спочатку, тому не знайшла різницю маси колби до заповнення і маси повітря, тобто фактично масу порожньої колби.
• Порівняйте густину вуглекислого газу, отриману Артемом і Юлею, із довідниковою. Чи можна впевнено визначити, хто з них акуратніше виконав експеримент?
Густина вуглекислого газу, отримана Артемом, дорівнює 1,60 г/л, а, отримана Юлею, дорівнює 1,80 г/л. Довідникове значення густини 1,83 г/л. Юля акуратніше виконала експериметр, бо отриманий нею результат густини практично співпадає із довідниковим, допущена нею похибка вимірювання мінімальна.
• Чим пояснюється розбіжність результату Артема з довідниковим?
Артем не переконався, що вуглекислий газ повністю заповнив колбу й, відповідно, обчислена ним густина (1,60 г/л) є значно меншою від довідникової (1,83 г/л) за рахунок легшого за масою повітря в незаповненій повністю вуглекислим газом колбі.
• Чи можна вважати результат Юлі помилковим? Чому?
Результат Юлі вважати помилковим не можна, бо обчислена нею густина майже дорівнює довідниковій. Невелика розбіжність у декілька сотих числа (0,03 г/л) може бути результатом похибки вимірювання.
Вправа 249
Для одержання вуглекислого газу в лабораторії використовують прилад, зображений на малюнку. Проаналізуйте його та поясніть призначення кожного елемента цього приладу.
Ділильна лійка з хлоридною кислотою призначена для акуратного і поступового зливання хлоридної кислоти до мармуру, регулюючи таким чином швидкість виділення газу.
Реакційна колба призначена безпосередньо для здійснення хімічної реакції між кальцій карбонатом та хлоридною кислотою.
Колба з водою призначена для очищення вологого вуглекислого газу від домішок хлоридної кислоти, що добре розчиняється у воді, та її парів.
Колба з концентрованою сульфатною кислотою (H2SO4 конц.) призначена для осушування вологого вуглекислого газу від водяної пари.
Колба з кальцій хлоридом (CaCl2) призначена для додаткового осушування залишкової вологи з газу.
Газовідвідна трубка призначення для виведення газу під час виконання дослідів.
НАВЧАЛЬНЕ ДОСЛІДЖЕННЯ № 7
«Досліджуємо розпушувальну дію вуглекислого газу»
Поміркуйте
За якою ознакою можна оцінити ефективність розпушувача тіста?
За збільшенням розмірів (об'єму) колобків можна оціними ефективність розпушувача тіста, який завдяки бульбашкам вуглекислого газу робить випічку пористою, і таким чином "піднімає" тісто.
Виміряйте та занотуйте розмір тістечок й оцініть їхній об'єм.
| Номер зразка | 1 | 2 | 3 |
| Розпушувач | сухі дріжді | порошок до печива | харчова сода |
| Розмір колобків | найбільші | середні | найменші |
| Об'єм колобків | 110 см3 | 90 см3 | 80 см3 |
Для підбиття підсумків обговоріть питання
1 За якими параметрами можна оцінити ефективність розпушувача? Чи варто зважувати колобки після випікання?
Розміри (об'єми) спечених колобків збільшилися по-різному, значить бульбашок вуглекислого газу утворюється різна кількість, тому різною є ефективність розпушувача. Колобки після випікання зважувати не варто, адже об'єм визначили за лінійними розмірами, а не густиною.
2 У який спосіб можна оцінити об'єм випеченої продукції?
Об'єм випеченої продукції можна оцінити візуально, порівнявши лінійні розміри випечених колобків.
3 Який процес є основою розпушування тіста? Яке значення вуглекислого газу в цьому процесі?
Основою розпушування тіста є хімічна реакція або біологічний процес бродіння з виділенням вуглекислого газу. Бульбашки вуглекислого газу роблять тісто пористим, таким чином "піднімають" тісто.
4 За інформацією на етикетці використаного вами готового розпушувача визначте речовини, що містяться в його складі. На якій хімічній реакції ґрунтується дія цього розпушувача?
До складу готового розпушувача входить борошно, сода і кислий компонент. Дія цього розпушувача ґрунтується на хімічній реакції між содою і кислотою за наявності вологи й тепла, внаслідок чого виділяється вуглекислий газ.
5 Який із розпушувачів є найбільш / найменш ефективним?
Найбільш ефективними є дріжджі, потім готовий розпушувач, а найменш ефективною є сода.
НАВЧАЛЬНЕ ДОСЛІДЖЕННЯ № 8
«Досліджуємо вуглекислий газ»
Поміркуйте
Запропонуйте план дослідження для порівняння густин вуглекислого газу і повітря; доведення того факту, що вуглекислий газ не підтримує горіння; перевірки способу виявлення вуглекислого газу.
• порівняння густин вуглекислого газу і повітря;
Пропускати вуглекислий газ у склянку з палаючими свічками різної висоти.
• доведення того факту, що вуглекислий газ не підтримує горіння;
Спостерігати в якому порядку гаснуть свічки в склянці під час пропускання вуглекислого газу.
• перевірки способу виявлення вуглекислого газу.
Спостерігати за помутнінням вапняної води.
Хід роботи
1 Збираємо прилад для одержання вуглекислого газу (апарат Кіппа або інші).
2 У склянку з водою додаємо декілька крапель розчину універсального індикатору та пропускайте крізь воду вуглекислий газ. Що ви спостерігаєте? Про що свідчать ваші спостереження?
Спостерігаємо, що колір розчину стає жовтий. Спостереження свідчать про те, що в розчині є слабка кислота.
3 У пластиковий стакан наливаємо воду (до половини) і додаємо декілька крапель розчину універсального індикатору. Крізь соломину продмухуємо повітря з легень у воду. Що ви спостерігаєте? Про що свідчать ваші спостереження?
Спостерігаємо, що колір розчину стає жовтий. Спостереження свідчать про те, що в розчині є слабка кислота.
4 Готуємо прилад для одержання вуглекислого газу. У широку склянку ставимо закріплені на дні свічки різної висоти й запалюємо їх. На дно склянки занурюємо газовідвідну трубку від приладу для одержання вуглекислого газу. Що ви спостерігаєте?
Спостерігаємо, що запалені свічки по черзі від нижчої до вищої гаснуть.
Які властивості вуглекислого газу доводять результати вашого спостереження?
Результати нашого спостереження доводять, що вуглекислий газ важчий за повітря і не підтримує горіння.
5 Запалюємо свічку. Чисту склянку ополіскуємо вапняною водою. Після ополіскування перегортаємо склянку догори дном і підносимо його згори до полум'я свічки. Що ви спостерігаєте? Спостерігаємо утворення білого нальоту на стінках склянки.
Ґрунтуючись на чому можна стверджувати, що під час горіння свічки утворюється вуглекислий газ?
Прозора вапняна вода реагує з вуглекислим газом з утворенням кальцій карбонату білого кольору на стінках склянки. Це якісна реакція для виявлення вуглекислого газу.
6 У склянку налийте вапняну воду. Соломиною продмухуйте видихуване повітря крізь вапняну воду. Що ви спостерігаєте? Про що свідчать ваші спостереження?
Спостерігаємо помутніння вапняної води в склянці — якісна реакція на вуглекислий газ. Спостереження свідчать про наявність вуглекислого газу.