Сторінка 59
15 Гідроген. Водень
Вправа 15.1
Запишіть у схему формули та назви летких сполук із Гідрогеном. Кольором позначте властивості цих речовин
| 13 | 14 | 15 | 16 | 17 | |
| 2–й період |
BH3 боран |
CH4 метан |
NH3 амоніак |
H2O вода, |
HF гідроген флоурид |
| 3–й період |
SiH4 силан |
PH3 фосфін |
H2S гідроген сульфід |
HCl гідроген хлорид |
|
| 4–й період |
GeH4 герман |
AsH3 арсин |
H2Se гідроген селенід |
HBr гідроген бромід |
|
| 5–й період |
SbH3 стибін |
H2Te гідроген телурид |
HI гідроген йодид |
||
– виявляють властивості основ
– виявляють властивості кислот
Вправа 15.2
Схарактеризуйте фізичні властивості водню.
| Характеристика | Опис |
| Хімічна формула | H2 |
| Відносна молекулярна маса | Mr(H2)=2Ar(H)=2•1=2 |
| Колір, запах | без кольору, без запаху |
| Агрегатний стан за звичайних умов | газ |
| Температура кипіння | –252,9 °С |
| Температура плавлення | –259,2 °С |
| Розчинність у воді | майже не розчиняється |
| Густина | 0,09 г/л |
| Значення в природі |
є в складі майже всіх органічних сполук і багатьох неорганічних. |
Обчисліть густину водню за н.у. і порівняйте її з густиною, наведеною в параграфі 15.
У параграфі 15 наведена густина водню за 0°С та нормального атмосферного тиску, що дорівнює 0,09 г/л.
Відомо: M(H₂) = 2 г/моль
Знайти: ρ(H2)-?
Розв'язання
M(H2)=2 г/моль
ρ(H2) = М(H2)/Vm = 2 г/моль : 22,4 л/моль = 0,09 г/л.
Відповідь: густина водню за нормальних умов 0,09 г/л. Значення густини співпадає із наведеним значенням у параграфі (за н.у.).
Сторінка 60
Вправа 15.4
Схарактеризуйте поширеність водню в природі у підписах до малюнків.
|
ВСЕСВІТ Сформувалися зорі і міжзоряний газ |
ГЕОТЕРМАЛЬНІ ДЖЕРЕЛА Насичені газами, в тому числі і воднем |
|
ВИВЕРДЖЕННЯ ВУЛКАНУ Виділяється при вулканічній активності |
КИШЕЧНИК Утворюється внаслідок діяльності деяких анаеробних бактерій |
Хімічні рівняння реакцій утворення простих речовин.
| а) 3H2 + N2 = 2NH3 | б) H2 + Cl2 = 2HCl | в) 2H2 + C → CH4 |
Вправа 15.6
Бланки для розв'язування задач №166, 167, 171 до підручника
Розв'язуємо задачу № 166
обчисліть масову частку водню у водному розчині, якщо за температури 20 °С розчиниться його максимальний обсяг. Порівняйте з масовою часткою кисню за аналогічних умов. До яких речовин (розчинних, малорозчинних чи практично нерозчинних) належать кисень і водень?
Дано: V(H2) = 18,8 мл = 0,0188 л, V(O2) = 6,7 мл = 0,0067 л
Знайти: w(H2)–?, w(O2)–?
Розв'язання
M(O2) = 32 г/моль, M(H2) = 2 г/моль
n(H2) = V(Н2) : Vm = 0,0188 л : 22,4 л/моль ≈ 8,39 • 10−4 моль
n(О2) = V(О2) : Vm = 0,0067 л : 22,4 л/моль ≈ 2,99 • 10−4 моль
m(Н2) = n(H2) • M(H2) = 8,39 • 10−4 моль • 2 г/моль ≈ 0,001678 г
m(O2) = n(O2) • M(O2) = 2,99 • 10−4 моль • 32 г/моль ≈ 0,009568 г
m(O2) = n(O2) • M(O2) = 2,99 • 10−4 моль • 32 г/моль ≈ 0,009568 г
w(H2) = 0,001678 г : 1,001678 г • 100% ≈ 0,168%
w(О2) = 0,009568 г : 1,009568 • 100% ≈ 0,948%
Відповідь: водень і кисень належать до практично нерозчинних у воді речовин.
Розв'язуємо задачу № 167
Обчисліть масову частку водню, розчиненому в паладії, якщо в металі розчиниться максимальна кількість газу. Густина паладію — 12,02 г/см3. Для розрахунків використайте дані з параграфа.
Дано: ρ(H2) = 0,00009 г/см3; ρ(Pd) = 12,02 г/см3, V(H2):V(Pd) = 850 : 1
Знайти: w(H2)–?
Розв'язання
m(H2) = V(H2) • ρ(Н2) = 850 см3 • 0,00009 г/см3 = 0,0765 г
m(Pd) = V(Pd) • ρ(Pd) = 1 см3 • 12,02 г/см3 = 12,02 г
m(р–ну) = m(H2) + m(Pd) = 0,0765 + 12,02 = 12,0965 г
w(H2) = m(H2) : m(р–ну) = 0,0765 г : 12,0965 г = 0,0063, або 0,63%
Відповідь: w(H2)=0,63%.
Сторінка 61
Розв'язуємо задачу № 171
Газуватий водень у продаж постачають у балонах об'ємом 40 л, пофарбованих зазвичай у зелений колір. За підвищеного тиску в такий балон уміщується близько 560 г водню. Порівняйте, де міститься більше водню: в 1 балоні об'ємом 40 л чи в бруску паладію такого самого об'єму.
Дано: V(Pd) = 40 л = 40000 см3, V(H2):V(Pd) = 850 : 1
Знайти: m(H2) –?
Розв'язання
V(H2) = V(Pb) • 850 = 40 л • 850 = 34000 л
n(H2)=V(H2)/Vm = 34000 л : 22,4 л/моль = 1517,86 моль
M(H2)=2 г/моль
m(H2) = n(H2) • M(H2) = 1517,86 моль • 2 г/моль= 3036 г
3036 : 560 = 5,42 (рази)
Відповідь: у бруску паладію об'ємом 40 л розчиниться 3036 г водню. Це в 5,42 раза більше, ніж міститься в балоні.
Вправа 15.7
Проаналізуйте графік і дайте відповіді.
1 Запишіть хімічне рівняння процесу атомізації водню. H2 → 2H
2 Дізнайтеся значення слова «дисоціація» і сформулюйте гіпотезу, чому цей термін тут є синонімом терміна «атомізація».
Оскільки дисоціація є процесом розпаду складних частинок (молекул, іонів) на простіші, а молекула водню розпадається з утворенням окремих атомів, тому терміни є синонімами.
3 У якому діапазоні температур «вигідно» існування лише молекул водню?
За температури нижчої від 2500 К
• За якої температури атомізація водню відбувається щонайменше на 5 %?
За температури близько 3800 К.
• Чи існують молекули водню на поверхні Сонця? А в атмосфері Юпітера?
Молекули водню не існують на поверхні Сонця, бо за температури близько 6000 К повністю атомізують, але існують в атмосфері Юпітера, бо не зазнають атомізації за температури 110–300 К.
Сторінка 62
16. Водень: хімічні властивості та одержання
Вправа 16.1
Доповніть моделі атома Гідрогену та йонів, які він може утворити.
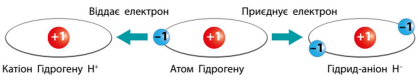
Вправа 16.2
Схарактеризуйте хімічні властивості водню, заповнивши таблицю.
|
Хімічні рівняння
|
Умови перебігу
|
|
Реакції з неметалами
|
|
|
H2 + F2 = 2HF
|
за звичайних умов з вибухом
|
|
H2 + Cl2 = 2HCl
|
освітлення (hν)
|
|
2Н2 + О2 = 2Н2О
|
температура (t) або каталізатор (кат.)
|
|
Н2 + S = Н2S
|
температура (t)
|
|
3H2 + N2 = 2NH3
|
температура, тиск, каталізатор (t, p, кат.)
|
|
2H2 + C → CH4
|
температура (t)
|
|
Реакції з металами
|
|
|
Н2 + 2Na = 2NaH
|
температура (t)
|
|
Н2 + Са = СаН2
|
температура (t)
|
|
Реакції з оксидами
|
|
| Fe2O3 + ЗН2 = 2Fe + 3H2O | температура (t) |
| CuO + Н2 = Cu + Н2O | температура (t) |
| WO3 + 3H2 = W + 3H2O | температура (t) |
Вправа 16.3
Запишіть формули та систематичні назви сполук Гідрогену з:
|
КH — калій гідрид
LiH — літій гідрид
MgH2 — магній гідрид
|
SrH2 — стронцій гідрид
AlH3 — алюміній гідрид
|
Сторінка 63
Вправа 16.4
Рівняння реакції речовин із воднем.
|
Ag2O + H2 = 2Ag + H2O
|
MnO + H2 = Mn + H2O
|
Вправа 16.5
Бланки для розв'язування задач №180–185 до підручника
Розв'язуємо задачу № 180
Обчисліть об'єм водню (н. у.), який витрачається під час одержання заліза з ферум (3+) оксиду масою 160 кг.
Відомо: m(Fe2O3) = 160 кг = 160000 г
Знайти: V(H2)–?
Розв'язання
M(Fe2O3)=160 г/моль
n(Fe2O3) = m(Fe2O3):M(Fe2O3) = 160000 г : 160 г/моль = 1000 моль
Записуємо рівняння реакції: Fe2O3 + 3H2 = 2Fe + 3H2O
n(Fe2O3):n(H2)=1:3, тому n(H2)=n(Fe2O3) • 3 : 1 = 1000 моль • 3 : 1 = 3000 моль
V(H2) = n(H2) • Vm = 3000 моль • 22,4 л/моль = 67200 л, або 67,2 м3
Відповідь: витратиться 67,2 м3 водню.
Розв'язуємо задачу № 181
Обчисліть масу цинку, яка знадобиться для одержання водню об'ємом 5,6 л (н.у.).
Відомо: V(H2) = 5,6 л
Знайти: m(Zn)–?
Розв'язання
Записуємо рівняння реакції: Zn + 2HCl = ZnCl2 + H2
V(Zn):V(H2)=1:1, тому V(Zn)=V(H2) = 5,6 л
n(Zn) = V(Zn) : Vm = 5,6 л : 22,4 л/моль = 0,25 моль
M(Zn)=65 г/моль
m(Zn) = n(Zn)• M(Zn) = 0,25 моль • 65 г/моль = 16,25 г
Відповідь: знадобиться 16,25 г цинку.
Розв'язуємо задачу № 182
Обчисліть об'єм водню (н. у.), необхідний для одержання метану масою 44 г.
Відомо: m(CH4) = 44 г
Знайти: V(H2)–?
Розв'язання
M(CH4)=16 г/моль
n(CH4) = m(CH4):M(CH4) = 44 г : 16 г/моль = 2,75 моль
Записуємо рівняння реакції: C + 2H2 = CH4
n(H2):n(CH4)=2:1, тому n(H2)=n(CH4) • 2 : 1 = 2,75 моль • 2 : 1 = 5,5 моль
V(H2) = n(H2) • Vm = 5,5 моль • 22,4 л/моль = 123,2 л
Відповідь: необхідно 123,2 л водню.
Розв'язуємо задачу № 183
Обчисліть масу витраченої води й об'єм утвореного кисню, якщо під час електролізу одержано 2 м3 водню (н.у).
Відомо: V(H2) = 2 м3 = 2000 л
Знайти: m(H2O)–?, V(O2)–?
Розв'язання
Записуємо рівняння реакції: 2H2 + O2 = 2H2O
V(H2):V(O2)=2:1, тому V(O2)=V(H2) • 1 : 2 = 2м3 : 2 • 1 = 1 м3
V(H2):V(H2O)=2:2=1:1, тому V(H2O)=V(H2) = 2000 л
n(H2O) = V(H2O) : Vm = 2000 л : 22,4 л/моль = 89,27 моль
M(H2O)=18 г/моль
m(H2O) = n(H2O)• M(H2O) = 89,3 моль • 18 г/моль = 1607 г ≈ 1,6 кг
Відповідь: витратиться 1,6 кг води і утвориться 1 м3 кисню.
Розв'язуємо задачу № 184
Обчисліть об'єм водню (н. у.), необхідний для одержання амоніаку масою 340 кг.
Відомо: m(NH3) = 340 кг = 340000 г
Знайти: V(H2)–?
Розв'язання
M(NH3)=17 г/моль
n(NH3) = m(NH3):M(NH3) = 340000 г : 17 г/моль = 20000 моль
Записуємо рівняння реакції: N2 + 3H2 = 2NH3
n(H2):n(NH3)=3:2, тому n(H2)=n(NH3) • 3 : 2 = 20000 моль • 3 : 2 = 30000 моль
V(H2) = n(H2) • Vm = 30000 моль • 22,4 л/моль = 672000 л = 672 м3
Відповідь: необхідно 672 м3 водню.
Розв'язуємо задачу № 185
Обчисліть масу хром (3+) оксиду, який можна відновити, використовуючи водень об'ємом 44,8 л (н. у.). Обчисліть масу утвореного хрому.
Відомо: V(H2) = 44,8 л
Знайти: m(Cr2O3)–?, m(Cr)–?
Розв'язання
n(H2) = V(H2) : Vm = 44,8 л : 22,4 л/моль = 2 моль
Записуємо рівняння реакції: Cr2O3 + 3H2 = 2Cr + 3H2O
n(Cr2O3):n(H2)=1:3, тому n(Cr2O3)=n(H2) • 1 : 3 = 2 моль • 1 : 3 = 0,67 моль
n(H2):n(Cr)=3:2, тому n(Cr)=n(H2) • 2 : 3 = 2 моль • 2 : 3 = 1,33 моль
M(Cr2O3)=152 г/моль, M(Cr)=52 г/моль
m(Cr2O3) = n(Cr2O3)• M(Cr2O3) = 0,67 моль • 152 г/моль ≈ 102 г
m(Cr) = n(Cr)• M(Cr) = 1,33 моль • 52 г/моль ≈ 69,2 г
Відповідь: можна відновити 102 г хром (3+) оксиду з утворенням 69,2 г хрому.
Сторінка 64
Навчальне дослідження № 5
«Досліджуємо водень»
Обладнання: апарат Кіппа, кристалізатор із водою, соломинка, пробірки, сірники.
Речовини: цинк, хлоридна кислота, мильний розчин.
1. На малюнку позначте наявність реактантів в апараті Кіппа.
| Хлоридна кислота | |
| Кран | Водень H2 |
| Гранули цинку |
2. Як підтвердити або спростувати гіпотезу, що густина водню менша за густину повітря?
Спостерігати чи здіймаються мильні бульбашки, наповнені воднем, вгору.
3. Дослідіть фізичні властивості водню.
Виконайте дослід II за підручником. Які спостереження доводять або спростовують вашу гіпотезу?
Мильні бульбашки, наповнені воднем, здіймаються вгору, що доводить те, що густина водню менша за густину повітря.
Сторінка 65
4. Зберіть водень.
Виконайте дослід III за підручником. Опишіть, у який спосіб можна збирати водень. Чи є особливості збирання порівняно зі збиранням кисню?
Водень можна зібрати як витісненням води, так і витісненням повітря. Особливістю збирання водню є те, що пробірку треба тримати отвором униз, на відміну від збирання кисню.
5. Перевірте наявність водню.
Виконайте дослід IV за підручником. У який спосіб можна довести наявність водню в пробірці?
Піднести до отвору пробірки запалений сірник (запальничку).
Чи можна довести чистоту водню (наявність домішок кисню в ньому)?
Можна, адже чистий водень згоряє без гучних звуків, а суміш водню з киснем — з чутним хлопком.
Підбиваємо підсумки
1. За якою ознакою можна стверджувати, що реакція в апараті Кіппа відбувається?
Утворення бульбашок газу.
2. Апарат Кіппа — зручний прилад для одержання в ньому різних газів, а не лише водню, у лабораторії. Зручність насамперед полягає в тому, що апарат легко перемикається із зарядженого стану в робочий і навпаки лише поворотом крана на газовідвідній трубці. Поясніть:
а) як апарат Кіппа переходить у робочий стан після відкриття крана;
Хлоридна кислота з верхнього резервуару повністю заповнює нижній і потрапляє в середній.
б) як апарат переходить у заряджений стан після закриття крана.
Тиск газу витісняє кислоту у верхній резервуар і реакція припиняється.
3. Унаслідок якого процесу кислота з верхнього резервуара потрапляє в середній після відкриття крана?
Під дією атмосферного тиску.
4. Унаслідок яких фізичних процесів кислота піднімається у верхній резервуар після закриття крана?
Тиск газу тисне на рідину, витісняючи кислоту вгору.
Сторінка 66
5. Як результати дослідження (дослід II) доводять різницю густин водню та повітря?
Мильні бульбашки, наповнені воднем, здіймаються вгору.
6. На яких фізичних процесах ґрунтуються способи збирання водню витісненням води та витісненням повітря?
Водень малорозчинний у воді, тому його збирають способом витісненням води. Густина водню менша за густину повітря, тому пробірку тримають отвором униз, збираючи водень способом витісненням повітря.
7. На чому ґрунтується спосіб виявлення водню?
На здатності водню горіти в суміші з повітрям чутним звуком — хлопком.
8. На чому ґрунтується спосіб визначення чистоти зібраного водню?
На здатності чистого водню горіти без чутного звуку.