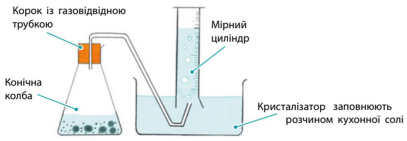
Чи можливо дослідити активність металу за його реакцією з кислотою.
2. Виконай експеримент відповідно до опису в підручнику.
Опишіть свої спостереження: магній реагує дуже бурхливо (рідина ніби закипає), алюміній і цинк взаємодіють значно спокійніше, залізо і олово реагують зовсім повільно (бульбашки водню ледве утворюються), а мідь зовсім не взаємодіє з кислотою.
Чи можна за результатами спостереження дізнатися про активність металів? Чим бурхливіше реагує метал, витісняючи водень з кислоти, тим активнішим є метал.
Хімічні рівняння здійснених реакцій:
| з хлоридною кислотою |
з сульфатною кислотою |
|
Mg + 2HCl = MgCl2 + H2↑
2Al + 6HCl = 2AlCl3 + 3H2↑
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
Sn + 2HCl = SnCl2 + H2↑
|
Mg + H2SO4 = MgSO4 + H2↑
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
Zn + H2SO4 = ZnSO4+ H2↑
Fe + H2SO4 = FeSO4 + H2↑
Sn + H2SO4 = SnSO4 + H2↑
|
Розташування символів досліджених металів у ряд від найактивнішого до найменш активного: Mg, Al, Zn, Fe, Sn, Cu
Порівняйте свій ряд із рядом активності металів на форзаці 2 підручника.
Наш ряд співпадає із рядом активності металів.
Сторінка 71
Підбиваємо підсумки.
1. Чи можливо схарактеризувати активність металу за спостереженням його реакції з кислотою? Відповідь аргументуйте.
Можливо схарактеризувати. Чим активніший метал, тим бурхливіша його взаємодія з кислотою.
2. Як варто враховувати розчинність продукту реакції для визначення кислоти, яку треба додавати до певного металу?
Якщо сіль розчинна у воді, то металічний елемент у ній може бути витиснутий активнішим металом з утворенням кислоти.
3. Яку ознаку реакції металів із кислотами можна використовувати для порівняння активності металів?
Метали, розміщені в ряду активності ліворуч від водню, здатні витісняти водень з розчинів кислот.
4. Чи існує будь–яка залежність (кореляція) між місцем металічного елемента в Періодичній таблиці та активністю відповідного металу?
Так, існує. Серед металів найактивнішим є калій, а найменш активним — золото.
5. Чи збігається складений вами ряд активності металів із надрукованим на форзаці підручника? Обґрунтуйте збіжності та розбіжності.
Наш ряд співпадає з рядом активності металів. Розбіжності можуть виникнути у випадку металів, що близькі за хімічними властивостями, тому висновки з візуального спостереження можуть не співпадати.
Сторінка 72
18. Ряд активності металів
Вправа 18.1
Запишіть продукти реакції.
|
метал + кислота → сіль + H2↑
|
|
метали (Li, K, Ca, Na) + H2O → луг + H2↑
|
|
метали (Al, Mn, Zn, Fe) + H2O → оксид + H2↑
|
Вправа 18.2
| Хімічні рівняння |
Умови перебігу |
| Реакції з кислотами |
| 2Li + 2HCl = 2LiCl + H2↑ |
За звичайних умов |
| 2K + 2HCl = 2KCl + H2↑ |
За звичайних умов |
| Ca + H2SO4 = CaSO4 + H2↑ |
За звичайних умов |
| 2Na + 2HCl = 2NaCl + H2↑ |
За звичайних умов |
| Mg + 2HCl = MgCl2 + H2↑ |
За звичайних умов |
| Zn + H2SO4 = ZnSO4 + H2↑ |
За нагрівання |
| Реакції з водою |
| 2Li + 2Н2O = 2LiOH + Н2↑ |
За звичайних умов |
| 2Na + 2Н2O = 2NaOH + Н2↑ |
За звичайних умов |
| Zn + H2O = ZnO + H2↑ |
За нагрівання |
| Реакції з солями |
| CuSO4 + Fe = FeSO4 + Cu↓ |
За звичайних умов |
| 2AgNO3 + Cu = Cu(NO3)2 + 2Ag↓ |
За звичайних умов |
| CuSO4 + Zn = ZnSO4 + Cu↓ |
За звичайних умов |
| Реакції з оксидами |
| CuO + Pb = PbO + Cu |
За нагрівання (розплавлення) |
| Fe2O3 + 2Al = Al2O3 + 2Fe |
За нагрівання (розплавлення) |
| ZnO + 2Na = Na2O + Zn |
За нагрівання (розплавлення) |
Сторінка 73
Вправа 18.3
1. Метали до водню. Виграшний горизонтальний рядок: Cu, Au, Ag
2. Метали, реагують з кислотами. Виграшний вертикальний рядок: K, Na, Zn.
Вправа 18.4
| Активність металів збільшується |
|
Із розчинами кислот
утворюють солі та водень
|
Із розчинами кислот
не реагують
|
|
Витісняють
водень з води
утворюючи
луги
|
Витісняють водень із води
за високої температури,
утворюючи
оксиди
|
Із кислотами
не реагують
|
|
Із водного розчи-
ну солі витиснути
неможливо
|
Метал можна одержати витісненням його з розчину
солі активнішим металом
|
Вправа 18.5
У розчин нікель (2+) сульфату занурили свинцеву та залізну пластини. З яким металом реакція відбуватиметься?
Із залізом. Залізо в ряді активності металів розміщується лівіше.
Вправа 18.6
Чому для одержання міді з розчину купрум (2+) сульфату не можна використовувати натрій і калій, адже вони активніші за мідь? Чи можна їх використовувати для одержання міді з розплаву купрум (2+) оксиду? Відповідь поясніть.
Натрій і калій взаємодіють з водою, а не з розчиненою сіллю вній, з утворенням лугів.
Для одержання міді з розплаву можна, бо в розплавлених оксидах води немає.
Вправа 18.7
Які речовини утворюються під час взаємодії води:
а) з активними металами; Луги і водень.
б) оксидами активних металічних елементів; Луги.
в) оксидами неметалічних елементів? Кислоти.
Сторінка 74
Вправа 18.8
Запишіть можливі реакції.
| a) Mg + H2SO4 = MgSO4 + H2↑ |
е) Ni + H2SO4 = NiSO4 + H2↑ |
| б) Fe + 2HBr = FeBr2 + H2↑ |
є) Аu і НСl; |
| в) Hg і НСl; |
ж) Рb і НСl; |
| г) 2Al + 6HI = 2AlI3 + 3H2↑ |
з) Sn + H2SO4 = SnSO4 + H2↑ |
| д) Cu і Н3РO4; |
и) Zn + 2HBr = ZnBr2 + H2↑ |
Вправа 18.9
Запишіть можливі реакції. Вкажіть назви продуктів реакції.
|
a) 2K + 2H2O = 2KOH + H2↑
Калій гідроксид і водень
|
е) 3Mn + 4H2O = Mn3O4 + 4H2↑
Манган (+2,+3) оксид і водень
|
|
б) Sr + 2H2O = Sr(OH)2 + H2↑
Стронцій гідроксид і водень
|
є) Sn; |
|
в) Ba + 2H2O = Ba(OH)2 + H2↑
Барій гідроксид і водень
|
ж) Ag; |
Вправа 18.10
Запишіть можливі реакції. Вкажіть назви продуктів реакції.
|
а) FeSO4 + Sn
|
ж) 3Zn + 2CrCl3 = 3ZnCl2 + 2Cr↓
Цинк хлорид і хром
|
|
б) Cu + 2AgNO3 = Cu(NO3)2 + 2Ag↓
Купрум (+2) нітрат і срібло
|
и) Al2(SO4)3 + Рb
|
|
в) 2Al + 3NiCl2 = 2AlCl3 + 3Ni↓
Алюміній хлорид і нікель
|
к) Zn + SnCl2 = ZnCl2 + Sn↓
Цинк хлорид і олово
|
|
г) CuSO4 + Hg
|
л) Zn + FeCl2 = ZnCl2 + Fe↓
Цинк хлорид і залізо
|
|
д) Hg(NO3)2 + Cu = Cu(NO3)2 + Hg↓
Купрум (+2) нітрат і ртуть
|
м) Fe + NiSO4 = FeSO4 + Ni↓
Ферум (II) сульфат і нікель.
|
|
е) Ag + Hg(NO3)2 = AgNO3 + Hg↓
Аргентум (+1) нітрат і ртуть
|
н) 2Al + 3CuBr2 = 2AlBr3 + 3Cu↓
Алюміній бромід і мідь.
|
Вправа 8.11
Підтвердіть реагування речовини з водою хімічним рівнянням.
| а) 2Na + 2H2O = 2NaOH + H2↑. |
г) H2SO4 |
| б) 2Fe + 3H2O = Fe2O3 + 3H2↑ |
д) NaOH |
| в) Fe2O3 |
е) CaO + H2O = Ca(OH)2 |
Вправа 8.12
Запишіть можливі реакції. Вкажіть назви продуктів реакції.
|
a) Zn + PbO = ZnO + Pb↓
Цинк оксид і свинець.
|
г) CuO + Au
|
|
б) Fe2O3 + 3Ca = 3CaO + 2Fe↓
Кальцій оксид і залізо.
|
д) Al2O3 + Cr
|
|
в) 3NiO + 2Al = Al2O3 + 3Ni↓
Алюміній оксид і нікель.
|
е) Cr2O3 + Zn
|
Сторінка 75
Вправа 18.13
Бланки для розв'язування задач №214-220.
Розв'язуємо задачу № 214
Після занурення цинкової пластини в розчин купрум (2+) нітрату на пластині виділилася мідь масою 3,2 г. Обчисліть масу цинку, що прореагував.
Відомо: m(Cu)=3,2 г
Знайти m(Zn)–?
Розв'язування
М(Cu)=64 г/моль, М(Zn)=65 г/моль
n(Cu)=m(Cu)/M(Cu)=3,2 г : 64 г/моль=0,05 моль
Записуємо рівняння реакції: Cu(NO3)2+Zn=Zn(NO3)2+Cu
n(Zn)=n(Cu)=0,05 моль
m(Zn)=n(Zn)•M(Zn)=0,05 моль•65 г/моль=3,25 г
Відповідь: 3,25 г.
Розв'язуємо задачу № 215
Обчисліть масу олова, яке можна одержати взаємодією станум (2+) оксиду з алюмінієм масою 0,54 кг.
Відомо: m(Al)=0,54 кг = 540 г
Знайти m(Sn)–?
Розв'язання
М(Al)=27 г/моль, М(Sn)=119 г/моль
n(Al)=m(Al)/M(Al)=540 г : 27 г/моль=20 моль
Записуємо рівняння реакції: 3SnO+2Al=Al2O3+3Sn
n(Sn)/n(Al)=3/2, тому n(Sn)=n(Al)•3:2=20 моль•3:2=30 моль
m(Sn)=n(Sn)•M(S)=30 моль•119 г/моль=3570 г = 3,576 кг
Відповідь: 3,576 кг.
Розв'язуємо задачу № 216
Обчисліть об'єм водню (н.у.), який виділиться внаслідок узаємодії цинку масою 97,5 г із хлоридною кислотою.
Відомо: m(Zn)=97,5 г
Знайти: V(H2)–?
Розв'язання
M(Zn)=65 г/моль
n(Zn)=m(Zn)/M(Zn)=97,5 г : 65 г/моль=1,5 моль
Записуємо рівняння реакції: Zn+2HСl=ZnCl2+H2↑
n(H2)=n(Zn)=1,5 моль
V(H2)=n(H2)•VM=1,5 моль•22,4 л/моль=33,6 л
Відповідь: 33,6 л водню.
Розв'язуємо задачу № 217
Обчисліть кількість речовини сульфатної кислоти, необхідної для взаємодії з магнієм масою 12 г. Обчисліть масу утвореної солі та об'єм утвореного газу (н.у.).
Відомо: m(Mg)=12 г
Знайти: n(Н2SО4)–?, m(MgSO4)–?, V(H2)–?
Розв'язання
М(Mg)=24 г/моль, М(MgSО4)=120 г/моль
n(Mg)=m(Mg)/M(Mg)=12 г : 24 г/моль=0,5 моль
Записуємо рівняння реакції: Mg+H2SО4=MgSO4+H2↑
n(Н2SO4)=n(MgSO4)=n(H2)=n(Mg)=0,5 моль
m(MgSО4)=n(MgSО4)•M(MgSО4)=0,5 моль•120 г/моль=60 г
V(H2)=n(H2)•VM=0,5 моль•22,4 л/моль=11,2 л
Відповідь: 0,5 моль H2SO4, 60 г MgSO4 і 11,2 л H2.
Розв'язуємо задачу № 218
Обчисліть кількість речовини міді, яку можна виділити з розчину купрум (2+) сульфату, що містить 32 г цієї солі.
Відомо: m(СuSО4)=32 г
Знайти: n(Сu)–?
Розв'язання
М(СuSО4)=160 г/моль
n(СuSО4)=m(СuSО4)/M(CuSO4)=32 г : 160 г/моль=0,2 моль
Записуємо рівняння реакції: СuSО4+Fe=FeSO4+Cu
n(Сu)=n(СuSО4)=0,2 моль
Відповідь: 0,2 моль.
Розв'язуємо задачу № 219
Суміш магнію масою 6,0 г і заліза масою 16,8 г обробили достатньою кількістю розчину сульфатної кислоти. Обчисліть об'єм водню (н. у.), що виділиться під час реакції.
Відомо: m(Mg)=6 г, m(Fe)=16,8 г
Знайти: V(H2)–?
Розв'язування
M(Mg)=24 г/моль, M(Fe)=56 г/моль
n(Mg)=m(Mg)/M(Mg)=6 г : 24 г/моль=0,25 моль
n(Fe)=m(Fe)/M(Fe)=16,8 г : 56 г/моль=0,3 моль
Записуємо два рівняння реакцій.
Mg + H2SO4 = MgSО4 + H2↑ (1)
Fe + H2SO4 = FeSО4 + H2↑ (2)
n1(H2)=n(Mg)=0,25 моль
n2(H2)=n(Fe)=0,3 моль
V1(H2)=n1(H2)•VM=0,25 моль•22,4 л/моль=5,6 л
V2(H2)=n2(H2)•VM=0,3 моль•22,4 л/моль=6,72 л
V(H2)=V1(H2)+V2(H2)=5,6 л + 6,72 л=12,32 л
Відповідь: 12,32 л.
Розв'язуємо задачу № 220
У розчин аргентум (1+) нітрату масою 85 г із масовою часткою солі 2% занурили цинкову пластинку. Обчисліть масу срібла, що виділиться на пластинці після закінчення реакції. Обчисліть, як зміниться маса пластинки порівняно з її початковою масою.
Відомо: m(розчину)=85 г, ω(AgNO3)=2%
Знайти: m(Ag)–? ∆m(пластинки)–?
Розв'язування
М(AgNО3)=170 г/моль, М(Ag)=108 г/моль; М(Zn)=65 г/моль
m(AgNO3)=ω(AgNO3)•m(розчину):100%=2%•85 г:100%=1,7 г
n(AgNO3)=m(AgNO3)/M(AgNO3)=1,7 г : 170 г/моль=0,01 моль
Записуємо рівняння реакції: Zn+2AgNO3=Zn(NО3)2+2Ag
n(Zn)/n(AgNO3)=1/2, тому n(Zn)=n(AgNO3):2=0,01 моль:2=0,005 моль
n(AgNO3)/n(Ag)=2/2=1/1, тому n(Ag)=n(AgNO3)=0,01 моль
m(Ag)=n(Ag)•M(Ag)=0,01 моль•108 г/моль=1,08 г
m(Zn)=n(Zn)•M(Zn)=0,005 моль•65 г/моль=0,325 г
∆m(пластинки)=1,08 г – 0,325 г=0,755 г
Відповідь: 1,08 г Ag, на 0,755 г збільшилася.
Вправа 18.14
Прочитайте опис досліду, наведеного в завданні №224 у підручнику на с. 167, та дайте відповіді на запитання.
1 Запишіть рівняння реакції натрію з водою. 2Na + 2H2O = 2NaOH + H2↓
2 Яке спостереження свідчить про утворення водню?
Газ штовхав шматочок натрію по поверхні води.
А натрій гідроксиду? Рожевий колір розчину.
3 Яка ознака активного перебігу цієї реакції?
Вирування розчину і утворення газу.
4 Чому шматочок натрію переміщався поверхнею води, а не тонув.
Натрій має меншу густину (легший за воду).
Які можливі ризики цього експерименту?
Розбрискування лугу, займання чи вибух газу.
5 3 опису експерименту наведіть приклади, як учитель контролював ризики для себе та учнівства в класі.
Використав захисний екран і окуляри, користувався пінцетом, брав невеликі порції речовин, зберігав правильно натрій.
Вправа 18.15
Прочитайте завдання №226 у підручнику на с. 168 і дайте відповіді на запитання.
1 Чому з алюмінієвими виробами нічого не трапляється в повітрі або в разі занурення у воду? Вони покриті міцною й хімічно інертною оксидною плівкою.
2 Припустіть, яка речовина прореагує першою, якщо гранулу алюмінію помістити в хлоридну кислоту.
Хлоридна кислота спочатку прореагує з алюміній оксидом — оксидною плівкою.
3 Чому реакція алюмінію з хлоридною кислотою із часом прискорюється?
Після розчинення оксидної плівки, кислота реагує з активним металом.
Сторінка 77
19. Вуглекислий газ
Вправа 19.1
Схарактеризуйте фізичні властивості газу, заповнивши таблицю
| Характеристика |
Опис |
| Хімічна формула |
CO2 |
| Відносна молекулярна маса |
Mr(CO2)=44 |
| Колір, запах |
безбарвний, без запаху |
|
Агрегатний стан за звичайних умов
|
газоподібний |
| Температура кипіння |
–56,6 °С (5 атм) |
| Температура СУБЛІМАЦІЇ |
–78,5 °С (1 атм) |
| Розчинність у воді |
помірна розчинність |
| Густина |
1,977 г/л |
| Значення в природі |
Реактант фотосинтезу
|
Вправа 19.2
Схарактеризуйте способи одержання вуглекислого газу, заповнивши таблицю.
| Процес |
Хімічне рівняння |
Умови перебігу |
|
Горіння вугілля
(або сажі)
|
С + O2 = СO2 |
нагрівання |
|
Горіння метану й
інших вуглеводнів
|
СН4 + 2O2 = СO2 + 2Н2O |
нагрівання |
|
Розкладання кальцій
карбонату
|
СаСО3 = СаО + СO2↑ |
нагрівання
(t, 1000°C)
|
|
Реакція харчової
(питної) соди з
кислотою
|
NaHCO3 + НСl = NaCl + СО2↑ + Н2O |
|
|
Реакція кальцинова-
ної соди з кислотою
|
Na2CO3 + H2SO4 = Na2SO4 + CO2↑ + H2O |
|
|
Реакція кальцій кар-
бонату з кислотою
|
СаСO3 + 2НСl = СаСl2 + СO2↑ + Н2O |
|
Сторінка 78
Вправа 19.3
| Хімічні рівняння |
Умови перебігу |
| Реакція з водою |
| CO2 + H2O = H2CO3 |
за звичайних умов |
| Реакція з основними оксидами |
| CO2 + Na2O = Na2CO3 |
за звичайних умов |
| CO2 + СаO = CaCO3 |
за звичайних умов |
| Реакції з основами |
| Са(ОН)2 + СO2 = СаСO3↓ + Н2O |
за звичайних умов |
| 2NaОН + СO2 = Na2СO3↓ + Н2O |
за звичайних умов |
Вправа 19.4
Порівняйте розчинність кисню з розчинністю вуглекислого газу.
|
Кисень

|
Розчинність
<
Масова частка
<
|
Вуглекислий газ

|
Вправа 19.5
Обчисліть максимальний об'єм вуглекислого газу, який розчиняється у воді об'ємом 1 л (н.у.). Порівняйте його з розчинністю за 25 °С, якщо густина вуглекислого газу за такої температури 1,8 г/л.
Дано: V(H2O) = 1 л, ρ1(CO2)=1,977 г/л, ρ2(CO2)=1,8 г/л,
m1(CO2)=1,73 г, m2(CO2)=1,45 г.
Розв'язання
V1(CO2) = 1,73 г : 1,977 г/л ≈ 0,875 л
V2(CO2) = 1,45 г : 1,8 г/л ≈ 0,806 л
0,875 > 0,806.
Відповідь: з підвищенням температури розчинність зменшується.
Вправа 19.6
Запишіть хімічні рівняння реакцій горіння етану С2Н6 та пропану С3Н8, якщо продукти цих реакцій такі самі, як і під час згоряння метану.
| 2C2H6 + 7O2 = 4CO2 + 6H2O |
C3H8 + 5O2 = 3CO2 + 4H2O |
Сторінка 79
Вправа 19.7
Запишіть хімічні рівняння реакцій вуглекислого газу з:
а) магній оксидом: MgO + CO2 = MgCO3
б) натрій оксидом: Na2O + CO2 = 2NaOH
в) натрій гідроксидом: 2NaOH + CO2 = Na2CO3 + H2O
г) барій гідроксидом: Ba(OH)2 + CO2 = BaCO3 + H2O
Вправа 19.8
Бланки для розв'язування задач №233-237.
Розв'язуємо задачу № 233
На цукрових заводах для очищення цукрового екстракту використовують вуглекислий газ, який одержують прожарюванням кальцій карбонату. Обчисліть масу солі, необхідної для одержання вуглекислого газу об'ємом 1,12 м3 (н.у.).
Дано: V(CO2) = 1,12 м3 = 1120 л
Знайти: m(CaCO3)–?
Розв'язання
n(CO2) = V(CO2) : Vm = 1120 л : 22,4 л/моль = 50 моль
Записуємо рівняння реакції: CaCO3 = CaO + CO2↑
n(CaCO3)/n(CO2)=1/1, тому n(CaCO3) = n(СO2)= 50 моль
M(CaCO3) = 100 г/моль
m(CaCO3) = n(CaCO3) • M(CaCO3) = 50 моль • 100 г/моль = 5000 г = 5 кг.
Відповідь: 5 кг кальцій карбонату.
Розв'язуємо задачу № 234
Харчову (питну) соду часто використовують як розпушувач для випікання тістечок. Але перед додаванням до тіста соду «гасять» оцтом. Умовно припустивши, що гасити соду можна й хлоридною кислотою, обчисліть масу гідроген хлориду, який витрачається для гасіння харчової соди масою 10 г. Обчисліть об'єм утвореного вуглекислого газу (н.у.).
Дано: m(NaHCO3) = 10 г
Знайти: m(HCl)–?
Розв'язання
М(NaHCO3) = 84 г/моль, M(HCl) = 36,5 г/моль
n(NaHCO3) = 10 г : 84 г/моль = 0,119 моль
Записуємо рівняння реакції: NaHCO3 + HCl = NaCl + H2O + CO2↑
n(NaHCO3):n(HCl):n(CO2)=1:1:1, тому n(HCl) = n(CO2) = n(NaHCO3) = 0,119 моль
m(HCl) = n(HCl) : M(HCl) = 0,119 моль • 36,5 г/моль = 4,34 г.
V(CO2) = n(CO2) • Vn = 0,119 моль • 22,4 л/моль = 2,67 л.
Відповідь: потрібно 4,34 г HCl, при цьому утворюється 2,67 л CO2.
Розв'язуємо задачу № 235
Для очищення повітря закритих приміщень від вуглекислого газу, повітря можна пропускати крізь патрони з гашеним вапном — кальцій гідроксидом. У повітрі певного приміщення об'ємом 45 м3 (н.у.) накопичився вуглекислий газ до 0,056 % (за об'ємом). Обчисліть масу кальцій гідроксиду, необхідного для повного поглинання такого обсягу вуглекислого газу.
Дано: V(повітря) = 45 м3 = 45000 л; φ(CO2)=0,056%
Знайти: m(Ca(OH)2)–?
V(CO2) = V(повітря) • φ(CO2) : 100% = 45000 л • 0,056% : 100% = 25,2 л
n(CO2) = V(CO2) : Vm = 25,2 л : 22,4 л = 1,125 моль
Записуємо рівняння реакції: Ca(OH)2 + CO2 = CaCO3↓ + H2O
За рівнянням реакції n(Ca(OH)2)/n(CO2)=1/1, тому n(Ca(OH)2) = n(CO2) = 1,125 моль
Обчислюємо масу кальцій гідроксиду.
M(Ca(OH)2)=74 г/моль
m(Ca(OH)2) = n(Ca(OH)2) • M(Ca(OH)2) = 1,125 моль • 74 г/моль = 83,25 г
Відповідь: потрібно 83,25 г кальцій гідроксиду.
Розв'язуємо задачу № 236
Одна людина впродовж доби під час дихання виділяє близько 1 кг вуглекислого газу. Обчисліть масу кальцій оксиду, потрібного для повного поглинання такого обсягу газу.
Дано: m(CO2) = 1 кг = 1000 г
Знайти: m(CaO)–?
Розв'язання
M(CO2) = 44 г/моль, M(CaO) = 56 г/моль
n(CO2) = m(CO2):M(CO2) = 1000 г : 44 г/моль = 22,73 моль
Записуємо рівняння реакції: CaO + CO2 = CaCO3
n(CaO)/n(CO2)=1/1, тому n(CaO) = n(CO2) = 22,73 моль
m(CaO) = n(CaO) • M(CaO) = 22,73 г • 56 г/моль = 1272,88 г ≈ 1,27 кг.
Відповідь: потрібно 1,27 кг кальцій оксиду.
Розв'язуємо задачу № 237
Дано: V(CH4) = 560 л
Знайти: m(CaCO3)-?
Розв'язання
n(CH4) = V(CH4) : Vm = 560 л : 22,4 л/моль = 25 моль
Записуємо рівняння реакції горіння метану: CH4 + 2O2 = CO2 + 2H2O
n(CH4)/n(CO2)=1/1, тому n(CO2)=n(CH4)=25 моль
Записуємо рівняння реакції одержання карбонату: CO2 + Ca(OH)2 = CaCO3 + H2O
n(CO2)/n(CaCO3)=1/1, тому n(CaCO3)=n(CO2)=25 моль
M(CaCO3) = 100 г/моль
m(CaCO3) = n(CaCO3) • M(CaCO3) = 25 моль • 100 г/моль = 2500 г = 2,5 кг
Відповідь: одержано 2,5 кг кальцій карбонату.
Вправа 19.9
Проналізуйте будову вогнегасників і дайте відповіді на запитання.
• Поясніть значення вуглекислого газу для пожежогасіння, зважаючи на трикутник вогню.
Перекриває доступ повітря і охолоджує горючу речовину.
• Опишіть принцип дії вуглекислотного вогнегасника.
Скраплений вуглекислий газ випаровується, охолоджується і у вигляді "снігу" надходить в зону горіння.
• За інструкцією не можна триматися руками за патрубок. Поясніть цю вимогу.
Патрубок настільки охолоджується, що можна обморозити шкіри голих ділянок рук.
• Опишіть принцип дії повітряно–пінного вогнегасника.
Після розбиття колби кислота реагує з содою з утворенням вуглекислого газу, що витісняє піну через роструб.
• Яка функція піноутворювача в повітряно–пінному вогнегаснику?
Створення стійкої піни шляхом змішування з водою та повітрям, що перекриває доступ повітря і охолоджує горючу речовину.
Дайте відповіді на запитання.
1 Які фізичні явища відбуваються під час декофеїнізації?
Розчинення кофеїну, випаровування вуглекислого газу, кристалізація кофеїну, конденсація вуглекислого газу, скраплення газів.
2 Які способи розділення сумішей застосовують?
Екстракція (розчинення кофеїну), фільтрування (отримання зерен з розчину), випарювання (відділення кофеїну).
3 У додаткових джерелах знайдіть інформацію, у яких ще галузях з подібною метою використовують скраплений вуглекислий газ.
У фармацевтичній, харчовій, парфумерній та екологічній галузях.
Вправа 19.11
1 Запропонуйте схему приладу для цього експерименту.
2 За який час прореагувала вся кислота? За 5 хвилин.
3 Які змінні тепер вони мають контролювати в цьому експерименті? Час і об'єм.
4 Більше чи менше газу буде зібрано в другому експерименті? Відповідь поясніть.
Однаковий об'єм газу буде зібрано. Температура впливає на швидкість протікання реакції.
5 Припустіть, менший чи більший час знадобиться, щоб витратилася вся кислота. Відповідь поясніть.
Менше часу, бо підвищення температури пришвидшить реакцію.
6 Запропонуйте спосіб, у який можна перевірити це припущення.
Порівняти зафіксовані в таблиці і отримані результати.
Вправа 19.12
1 Опишіть призначення кожного елемента цього приладу.
Свічка — джерело вогню; лійка — збирання продуктів; U-подібна трубка — конденсація водяної пари; газовідвідна трубка — виводить газ; пробірка з вапняною водою — для виявлення вуглекислого газу.
Сторінка 82
2 Після запалення свічки учні й учениці очікували на швидке помутніння вапняної води, проте виявилося, що прилад не працює. Поясніть, у чому було припущено помилку в конструкції цього приладу.
Пробірка з вапняною водою розміщена нижче від рівня склянки з водою.
• Як можна змінити конструкцію приладу, щоб він запрацював?
Підняти пробірку з вапняною водою на рівень склянки з водою.
Вправа 19.13
1 Навіщо в цей прилад додали осушувач? Чи може вплинути на результати експерименту його відсутність?
Водяна пара є домішкою, без осушувача результати будуть помилковими.
2 Якої помилки припустився Артем?
Не переконався, що вуглекислий газ повністю заповнив колбу.
• Порівняйте густину вуглекислого газу, отриману Сніжаною, із довідниковою. Чому дані не збігаються? У чому припустилася помилки Сніжана?
Неправильно визначена маса вуглекислого газу. Не взяла до уваги масу повітря в колбі спочатку.
• Порівняйте густину вуглекислого газу, отриману Артемом і Юлею, із довідниковою. Чи можна впевнено визначити, хто з них акуратніше виконав експеримент?
Юля акуратніше виконала експериметр, бо отримана густина близька до довідникової.
• Чим пояснюється розбіжність результату Артема з довідниковим?
Вуглекислий газ не повністю заповнив колбу.
• Чи можна вважати результат Юлі помилковим? Чому?
Не можна вважати результат помилковим, бо майже дорівнює довідниковому.
Сторінка 83
НАВЧАЛЬНЕ ДОСЛІДЖЕННЯ № 7
«Досліджуємо розпушувальну дію вуглекислого газу»
Обладнання: три невеликі посудини для замішування тіста, ложки.
Речовини: борошно, вода, цукор, сухі дріжджі, харчова сода, столовий оцет, пакетик розпушувача тіста.
1. Висловіть гіпотезу, за якою ознакою можна оцінити ефективність розпушувача тіста.
За збільшенням розмірів (об'єму) спечених булочок можна оціними ефективність розпушувача тіста, який завдяки бульбашкам вуглекислого газу робить випічку пористою, і таким чином "піднімає" тісто.
2. Виконайте експеримент відповідно до плану, зафіксуйте в таблиці.
| Номер зразка |
1 |
2 |
3 |
| Розпушувач |
сухі дріжді |
порошок до печива |
харчова сода |
| Розмір булочок |
найбільші |
середні |
найменші |
| Об'єм булочок |
110 см3 |
90 см3 |
80 см3 |
Підбиваємо підсумки
1 За якими параметрами можна оцінити ефективність розпушувача? Чи підтвердилася ваша гіпотеза?
Розміри (об'єми) булочків збільшилися по-різному, значить бульбашок вуглекислого газу утворюється різна кількість, отже, різною є ефективність розпушувачів. Так, наша гіпотеза підтвердилася.
2 Чи варто зважувати булочки після випікання? Відповідь обґрунтуйте.
Ні, не варто, адже об'єм булочків визначили за лінійними розмірами спечених булочків.
Сторінка 84
3 У який спосіб можна оцінити об'єм випеченої продукції?
Оцінити візуально, порівнявши лінійні розміри випеченої продукції.
4 Який процес є основою розпушування тіста? Яке значення вуглекислого газу в цьому процесі?
Хімічна реакція або біологічний процес бродіння з виділенням вуглекислого газу. Бульбашки вуглекислого газу роблять тісто пористим, таким чином "піднімають" тісто.
5 За інформацією на етикетці використаного вами готового розпушувача визначте речовини, що містяться в його складі. На якій хімічній реакції ґрунтується дія цього розпушувача?
Борошно, сода і кислий компонент. Дія ґрунтується на хімічній реакції між содою і кислотою з виділенням вуглекислого газу.
6 Який із розпушувачів є найбільш / найменш ефективним?
Найбільш ефективними є дріжджі, потім готовий розпушувач, а найменш ефективною є сода.
Сторінка 85
НАВЧАЛЬНЕ ДОСЛІДЖЕННЯ № 8
«Досліджуємо вуглекислий газ»
Обладнання: апарат Кіппа, склянки, штатив із пробірками, свічки, пластиковий стакан і соломина.
Речовини: мармур, хлоридна кислота, вапняна вода.
1 Запропонуйте спосіб, у який можна:
порівняти густину вуглекислого газу й повітря;
Пропускати вуглекислий газ у склянку з палаючими свічками різної висоти.
доведення того факту, що вуглекислий газ не підтримує горіння;
Спостерігати як в склянці гаснуть свічки під час пропускання вуглекислого газу.
визначити спосіб виявлення вуглекислого газу.
За помутніння вапняної води.
2 Виконайте експериментальні дії за підручником, опишіть свої спостереження та поясніть їх.
|
Дії
|
Спостереження
|
Про що свідчать спостереження
|
| п. 2 |
Розчин стає жовтиим |
Утворюється слабка кислота |
| п. 3 |
Розчин стає жовтим |
Утворюється слабка кислота |
| п. 4 |
Запалені свічки по черзі від
нижчої до вищої гаснуть
|
Вуглекислий газ важчий за повітря і не
підтримує горіння
|
| п. 5 |
На стінках появляється
білий наліт
|
Якісна реакція на вуглекислий газ,
утворився нерозчинний кальцій карбонат
|
| п. 6 |
Помутніння вапняної води
в склянці
|
Якісна реакція на вуглекислий газ,
утворився нерозчинний кальцій карбонат
|