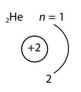| Частинка | Позначення | Заряд | Маса | Масове число | ||
| Кл | умовн. од. | г | а.о.м. | |||
| Електрон | е– | –1,6•10–19 | –1 | 9,1095•10–28 | 0,00055 | 0 |
| Протон | р | 1,6•10–19 | +1 | 1,6726•10–24 | 1,00728 | 1 |
| Нейтрон | n | 0 | 0 | 1,6750•10–24 | 1,00867 | 1 |
|
Діаграма Венна |
||
|
Відмінне |
Спільне
|
Відмінне |
|
Атом |
Хімічний елемент |
|
|
Матеріальна частинка (має масу, розмір, будову), перегруповуються в хімічних реакціях |
Фундаментальні поняття хімії
|
поняття класифікації певного виду атомів, міститься в Періодичній таблиці |
|
Діаграма Венна |
||
|
Відмінне |
Спільне
|
Відмінне |
|
Електрон |
Протон |
|
|
Негативно заряджений (–1), найлегший за масою, в складі електронної оболонки атома. |
Субатомні частинки, в складі атома.
|
Позитивно заряджений (+1), 1 а.о.м., в складі ядра атома
|
|
Діаграма Венна |
||
|
Відмінне |
Спільне
|
Відмінне |
|
Протон |
Нейтрон |
|
|
Позитивно заряджений (+1)
|
Субатомні частинки, в складі ядра атома, є нуклонами, маси майже однакові 1 а.о.м. |
Не має заряду (0)
|
Вправа 24.5
| Нукліди |
Число частинок |
Заряд ядра | Масове число | Позначення |
| Протій, Н | p = 1, n=0, e–=1 | +1 | 1 | 1H |
| Дейтерій, D | p = 1, n=1, e–=2 | +1 | 2 | 2H |
| Тритій, Т | p = 1, n=2, e–=3 | +1 | 3 | 3H |
|
Характеристики ядер |
Z = 2 N = 1 |
Z = 8 N = 9 |
Z = 15 N = 16 |
Z = 35 N = 45 |
Z = 25 N = 30 |
Z = 89 N = 117 |
| Позначення нукліда | 3He | 17O | 31P | 80Br | 55Mn | 206Ac |
| Нуклід | Число частинок |
Заряд ядра |
Масове число |
Позначення |
| Карбон–12 | p = 6, n = 6, e–= 6 | +6 | 12 | 12С |
| Стронцій–90 | p = 38, n = 52, e– = 38 | +38 | 90 | 90Sr |
| Цезій–137 | p = 55, n = 82, e– = 55 | +55 | 137 | 137Cs |
| Уран–235 | p = 92, n = 143, e–= 92 | +92 | 235 | 235U |
| 17O | p = 8, n = 9, e–= 8 | 19F | p = 9, n = 10, e–= 9 |
| 14C | p = 6, n = 8, e– = 6 | 56Fe | p = 26, n = 30, e–= 26 |
| 137Cs | p = 55, n = 82, e– = 55 | 39K | p = 19, n = 20, e–= 19 |
| 130I | p = 53, n = 77, e–= 53 | 206Pb | p = 82, n = 124, e–= 82 |
|
Хімічний елемент |
Символ елемента |
А |
Z | N |
|
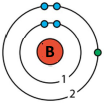
Бор |
B | 11 | 5 | 6 |
|
Оксиген |
О | 15 | 8 | 7 |
| Сульфур | S | 32 | 16 | 16 |
| Меркурій | Hg | 200 | 80 | 120 |
| Ферум | Fe | 56 | 26 | 30 |
б) нукліди з однаковим нейтронним числом:
168O (N=16–8=8), 146C (N=14–6=8), 157N (N=15–7=8)
в) нукліди з однаковим нуклонним числом (А=7): 146C, 147N
|
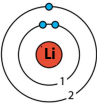
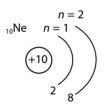
K n = 1 |
|
L n = 2 |
|
M n = 3 |
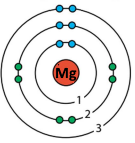
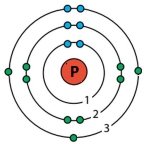
| Енергетичний рівень, n | 1 | 2 | 3 | 4 |
| Літерне позначення рівня | K | L | M | N |
| Максимальне число електронів – 2n2 | 2 | 8 | 18 | 32 |
|
Порядковий номер |
Хімічний елемент |
Період | Група |
Число енергетичних рівнів |
Число електронів на зовнішньому рівні |
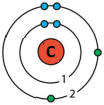
| 6 | С | 2 | 14 | 2 | 4 |
| 7 | N | 2 | 15 | 2 | 5 |
| 10 | Ne | 2 | 18 | 2 | 8 |
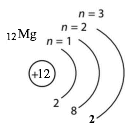
| 12 | Mg | 3 | 2 | 3 | 2 |
|
|
 |
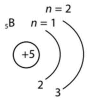 |
 |
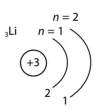 |
 |
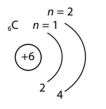 |
 |
а) два енергетичні рівні, а на зовнішньому — сім електронів F.
б) три енергетичні рівні, а на зовнішньому — п’ять електронів P.
в) два енергетичні рівні, а на зовнішньому — три неспарені електрони N.
г) три енергетичні рівні, а на зовнішньому — три неспарені електрони P.
Cторінка 109
Вправа 25.8
Доповнили електронну будову атомів і модель електронної оболонки.
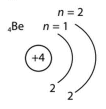 |
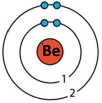 |
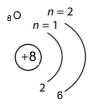 |
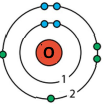 |
 |
 |
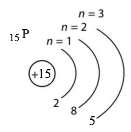 |
 |
Вправа 25.9
| Характеристика | Li | Na | K | Be | C | O | F | N |
|
Число електронів в електронній оболонці атома |
3 | 11 | 19 | 4 | 6 | 8 | 9 | 5 |
|
Число енергетичних рівнів, що заповнюються електронами |
2 | 3 | 4 | 2 | 2 | 2 | 2 | 2 |
|
Число електронів на зовніш– ньому енергетичному рівні |
1 | 1 | 1 | 2 | 4 | 6 | 7 | 5 |
|
Число електронних пар на зовнішньому рівні |
0 | 0 | 0 | 1 | 2 | 3 | 3 | 2 |
|
Число неспарених електронів на зовнішньому рівні |
1 | 1 | 1 | 0 | 2 | 2 | 1 | 3 |
Сторінка 110
| Група | |||||
| 1 | 2 | 15 | 16 | 17 | 18 |
| Лужні | Лужноземельні | Пніктогени | Халькогени | Галогени | Інертні |
| Лужні | Галогени | Інертні | |
|
Перетворюються на йони із зарядом |
1+ | 1– | — |
|
Загальна формула оксиду |
R2O
|
R2O7 (крім Флуору) |
— |
|
Загальна характеристика простих речовин
|
легкі і м'які метали, хімічно активні |
неметали, утворені двоатомними молекулами, хімічно активні |
неметали, утворені одноатомними молекулами, хімічно пасивні |
|
а) літієм; 2Li + I2 = 2LiI
б) алюмінієм; 2Al + 3I2 = 2AlI3
|
в) кальцієм; Ca + I2 = CaI2
г) воднем. H2 + I2 = 2HI
|
|
атом Алюмінію: p = 13 e– = 13
йон алюмінію Al3+: p = 13 e– = 10
|
атом Літію: p = 3 e– = 3
йон Літію Li+: p = 3 e– = 2
|
|
Хімічний елемент
|
Максимальне число електронів, що атом може | |
| віддавати | приймати | |
|
Хлор |
7 | 1 |
|
Карбон |
4 |
4 |
|
Нітроген |
5 |
3 |
|
Фосфор |
5 |
3 |
|
Сульфур |
6 |
2 |
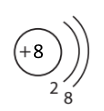
| Атом Магнію | Йон Магнію Mg2+ | Атом Неона | Йон Оксигену О2– |
 |
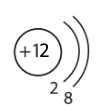 |
 |
 |
|
Ознака
|
Зайвий елемент
|
|
1 — інертні елементи
2 — металічні елементи
3 — елементи 2 періоду
4 — галогени
5 — лужноземельні елементи
6 — неметалічні елементи
7 — лужні елементи
8 — перехідні металічні елементи
|
Н — не є інертним
Ar — не є металічним
Н — елемент 1–го періоду
Mn — не є галогеном
Zn — не є лужноземельним
Na — металічний
Н — не є лужним
О — не є металічним
|
Знайти: R – ?
Розв’язання
Оксиду відповідає летка сполука з Гідрогеном складу H2R.
Cторінка 114
| Хімічний зв'язок | |||
|
↓ Ковалентний |
↓ Йонний |
↓ Металічний |
↓ Водневий |
| → полярний | |||
| → неполярний | |||
|
Нітрогену — 3 Сульфуру — 2 Флуору — 1 |
Хлору — 1 Карбону — 4 Оксигену — 2 |
|
Хімічний елемент |
До електронної оболонки якого елемента прагне? |
Атоми переваж– но віддають чи приймають елек– трони? |
Число електронів, що будуть відда– вати / приєднувати атоми |
| Літій | Гелій | віддають | 1 |
| Оксиген | Неон | приєднують | 2 |
| Кальцій | Аргон | віддають | 2 |
| Алюміній | Неон | віддають | 3 |
| Хлор | Аргон | приєднують | 1 |
| Літію 1 | Магнію 2 | Калію 1 |
| Алюмінію 3 | Фосфору 5 | Хлору 7 |
+ Притягання між атомами Гідрогену в молекулі понад 5000 разів сильніше, ніж між атомами Гелію.
+ Відстань між атомами Гідрогену в молекулі майже в 4 рази менша, ніж двома атомами Гелію.
+ Точка мінімуму на графіку потенційної енергії відповідає найбільш вигідному положенню атомів.
Cторінка 116
| Гідроген |
|
Фосфор |
|
| Карбон |
|
Сульфур |
|
| Оксиген |
|
Хлор |
|
| Нітроген |
|
Бром |
|
| Флуор |
|
Ксенон |
|
|
Молекула
|
Електронна формула
|
Структурна формула
|
Перекривання атомних орбіталей |
| H2 | |||
| F2 | |||
| HF | |||
| H2O | |||
| NH3 | 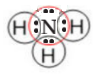 |
||
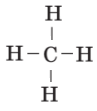
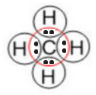
| CH4 | 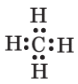 |
 |
 |
|
Cтруктурна формула
|
Електронна формула
|
Число спільних електронних пар |
Число неподілених електронних пар |
|
Оксиген — 2 Карбон — 4 |
Оксиген — 2 Карбон — 0 |
||
|
Оксиген — 2 |
Оксиген — 2 |
||
| Нітроген — 3 | Нітроген — 1 | ||
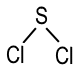 |
Сульфур — 2 Хлор — 1 |
Сульфур — 2 Хлор — 3 |
|
|
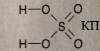
Сульфур — 4 Оксиген — 2 |
Сульфур — 0 Хлор — 2 |
Вправа 30.5
|
Атом Гідрогену утворює лише один зв'язок |
|
Атом Карбону утворює чотири зв'язки |
|
|
Атом Нітрогену утворює три зв'язки |
|
Атом Оксигену утворює два зв'язки |
|
| X:Y: ; HCl, HBr | Z:Z; F2, H2, Cl2 | А::А. O2 |
1) Між атомами яких хімічних елементів утворюється ковалентний зв’язок?
Між атомами однакових або різних неметалічних елементів.
2) Як визначити число спільних електронних пар, що їх може утворити атом?
За кількістю неспарених електронів на зовнішньому енергетичному рівні.
3) Яка електронна конфігурація характерна для найстабільніших частинок?
Конфігурація інертних елементів.
4) Що розуміють під полярністю ковалентного зв’язку?
Це зміщення електронної пари до більш електронегативного атома.
5) Атоми яких хімічних елементів утворюють зв’язок полярний, а яких — неполярний?
Атоми різних неметалічних елементів утворюють полярний зв'язок, а однакових — неполярний.
6) Що спільного між полярним і неполярним зв’язками?
У двох випадках зв'язок утворюється за рахунок спільних електронних пар.
7) Чим різняться полярний і неполярний зв’язки?
У полярному зв'язку спільна електронна пара зміщена до більш електронегативного елемента, а в неполярному — належить однаково обом атомам. Полярний зв'язок існує між атомами неметалічних елементів з різною електронегативністю, а неполярний — з однаковою.
8) Від чого залежить полярність ковалентного зв’язку?
Від різниці електронегативностей атомів.
9) Що розуміють під кратністю ковалентного зв’язку?
Кількість спільних електронних пар між двома атомами.
Cторінка 119
Вправа 31.5
Вправа 31.6
Вправа 31.7
|
Порівняння полярності молекул |
Обгрунтування |
| H2O > NH3 | електронегативність O > N |
| HCl > HBr | електронегативність Cl > Br |
| NH3 > PH3 | електронегативність N > P |
Ступінь окиснення — це умовний заряд на атомі в молекулі або кристалі, обчислений із припущенням, що всі спільні електронні пари повністю зміщені в бік більш електронегативного елемента.
Вправа 32.2
|
Металічні елементи |
→ вищий ступінь окиснення |
= |
максимальне число втрачених електронів |
|
→ нижчий ступінь окиснення |
= | 0 | |
|
Неметалічні елементи
|
→ вищий ступінь окиснення |
= |
номер групи мінус 10 |
|
→ нижчий ступінь окиснення |
= | номер групи мінус 18 |
Вправа 32.3
|
Хімічний елемент |
Вищий ступінь окиснення |
Проміжні ступені окиснення (якщо є) |
Нижчий ступінь окиснення |
|
Оксиген |
+2 |
0 |
–2 |
|
Хлор |
+7 | +5, +3, +1, 0 | –1 |
|
Фосфор |
+5 |
+3, 0 |
–5 |
|
Натрій |
+1 | — | 0 |
|
Кальцій |
+2 | — | 0 |
|
Карбон |
+4 | +2, 0 | –4 |
|
Плюмбум |
+2 | +2 | 0 |
|
Алюміній |
+3 | — | 0 |
Сторінка 121
Вправа 32.4
|
Група ПС |
1 |
2 |
13 |
14 |
15 |
16 |
17 |
|
Вищий ступінь окиснення |
+1 |
+2 |
+3 | +4 | +5 |
+6 (крім О) |
+7 (крім F) |
|
Проміжний ступінь окиснення |
0 | 0 | 0 | +2,0 | +3,0 | +4,+2,0 | +5,+3,+1,0 |
|
Нижчий ступінь окиснення |
0 |
0 |
0 | –4 | –3 | –2 | –1 |
Вправа 32.5
Вправа 32.6
Вправа 32.7
Cторінка 122
| Ознака
|
Речовини | |
| Аморфна | Кристалічна | |
|
За розташуванням части– нок у твердих речовинах |
невпорядковано
|
в чіткому порядку
|
|
За утворенням тіл певної форми |
не утворюють певну форму |
утворюють певну форму |
|
Що відбувається в разі руйнування? |
уламки неправильної форми |
штатки правильної форми |
| Температура плавлення |
діапазон температур |
стала температура |
| Приклади речовини |
скло, бурштин, смоли, клеї, каучук |
кухонна сіль, цукор, харчова сода, кварц |
Cторінка 123
|
Діаграма Венна |
||
|
Відмінне |
Спільне |
Відмінне |
|
речовини атомної будови |
речовини молекулярної будови |
|
|
У вузлах ґраток — окремі атоми. Міжатомний зв’язок — ковалентний. Нелеткі, надзвичайно тверді, тугоплавкі. Не розчиняються у розчинниках. |
Кристалічна ґратка. Хімічний зв'язок. Фізичні властивості
|
У вузлах ґраток — молекули. Слабка міжмолекулярна взаємодія. Крихкі, леткі, легкоплавкі. Деякі розчиняються у розчинниках. |
Гра «Хрестики й нулики».
1 — речовини молекулярної будови;
Виграшною є середній горизонтальний рядок.
F2, HBr, H2
2 — речовини атомної будови;
Виграшним є останній вертикальний стовпець.
С (графіт), SiO2, C (алмаз)
Cторінка 124
| Властивості речовин | Кристалічні ґратки |
|
Карборунд (силіцій карбід SiC), tпл. = 2830 °C, за твердістю близький до алмазу |
атомна |
|
Ванілін — безбарвна кристалічна речовина з приємним запахом |
молекулярна |
|
За звичайних умов кисень — газ без кольору, смаку та запаху, малорозчинний у воді, tкип.. = –183 °C, tпл. = –219 °C |
молекулярна |
|
Сірка є крихкою кристалічною речовиною жовтого кольору, не розчиняється у воді, tпл. = 112,8°C |
молекулярна |
|
Бром — червоно–бура рідина з різким запахом, легко випаровується, tкип. = 59 °C |
молекулярна |
|
Сульфур (VI) оксид за звичайних умов — летка безбарвна рідина їз задушливим запахом, tпл. = 16,8 °C, tкип. = 45 °C |
молекулярна |
|
Фтор за звичайних умов є зеленуватим газом із різким запахом, переходить у рідкий стан за температури –188,1 °C |
молекулярна |
|
Кристалічний силіцій є дуже твердою речовиною з металічним блиском, незначною електропровідністю, tпл. = 1414 °C |
атомна |
|
Діаграма Венна |
||
|
Відмінне |
Спільне |
Відмінне |
|
Ковалентний |
Йонний |
|
|
Виникає між атомами неметалічних елементів, спільні електронні пари, існує в молекулярних і атомних кристалах |
Тип хімічного зв'язку, перерозподіл електронів, виникає у простих і складних речовинах |
Виникає між атомами металічних і неметалічних елементів, притягання йонів, існує в йонних кристалах |
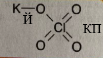
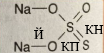
| а) | Натрій і Хлор | |
| б) | Калій і Флуор | |
| в) | Кальцій і Бром | |
| г) | Алюміній і Йод | |
| д) | Літій і Оксиген |
| Йон |
Заряд ядра |
Число електронів у йоні |
Йон |
Заряд ядра |
Число електронів у йоні |
| H+ | +1 | 0 | Mg2+ | +12 | 10 |
| O2– | +8 | 10 | Cl– | +17 | 18 |
| Na– | +11 | 10 | Al3+ | +13 | 10 |
Cторінка 126
 |
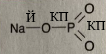 |
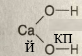 |
 |
 |
| Порівнювальна ознака | Тип кристалічних ґраток | ||
| Атомні | Молекулярні | Йонні | |
| Які частинки у вузлах ґраток? | атоми | молекули | йони |
| Тип хімічного зв'язку в речовинах | ковалентний | ковалентний | йонний |
|
Природа хімічних елементів
|
неметалічні
|
неметалічні
|
металічні і неметалічні |
|
Фізичні властивості: |
|
||
|
tпл. і tкип. |
дуже висока |
низька | висока |
|
леткість |
нелеткі |
леткі | нелеткі |
|
твердість |
дуже тверді |
крихкі | тверді |
|
запах |
ні | так | ні |
|
розчинність |
нерозчинні | частково розчинні | розчинні |
|
електропровідність |
ні | ні | так |
|
Речовина
|
Агрегатний стан |
Розчинність у воді |
Температура плавлення |
Крихкість
|
Електро– провідність |
|
натрій хлорид |
твердий
|
розчинний
|
висока
|
крихкий
|
має, у розчині |
|
цукор |
твердий |
розчинний |
низька |
крихкий |
не має |
| графіт | твердий | нерозчинний | дуже висока | крихкий | має |
|
силіцій (IV) оксид |
твердий
|
нерозчинний
|
дуже висока
|
твердий
|
не має
|