Інші завдання дивись тут...
© 8next.com (відповіді, перероблене і доповнене)
Поміркуйте
Сформулюйте гіпотезу, яка б пояснювала різні заряди ядер і відносні атомні маси атомів у різних хімічних елементів.
Заряди ядер і відносні атомні маси атомів у різних хімічних елементів є різними, бо хімічний елемент є різновидністю атома, що характеризується певним числом протонів і різною кількістю нейтронів в ядрі атома.
Поміркуйте
Проаналізуйте інформацію з таблиці 5. Чим відрізняються субатомні частинки (тобто частинки, з яких складаються атоми)?
Субатомні частинки відрізняються електричним зарядом (протони мають заряд +1, електрони мають заряд –1, а нейтрони не мають заряду) і масою (протони й нейтрони мають масу близько 1 а.о.м., тоді як електрони найлегші і їхня маса близько 0,00055 а.о.м.).
Поміркуйте
Якщо із частинок в ядрі атома лише протони мають заряд, то чим зумовлений заряд ядра? А чому атоми — нейтральні частинки?
Заряд ядра зумовлений числом протонів у його складі, оскільки нейтрони не мають електричного заряду, тому не впливають на загальну величин заряду. Будь–який атом є електронейтральною частинкою, бо число негативно заряджених електронів в атомі дорівнює числу позитивно заряджених протонів у ядрі, тому сумарний заряд атома дорівнює нулю.
Поміркуйте
Зважаючи на масу субатомних частинок, чим, на вашу думку, буде зумовлена маса атома?
Маса атома зумовлена сумою мас протонів і нейтронів у його ядрі, бо в ядрі зосереджено близько 99,97 % усієї маси атома, а маса електронів є настільки малою, що нею зазвичай нехтують.
Поміркуйте
Проаналізуйте малюнок 24.2. Моделі скількох атомів на ньому зображено?
На малюнку 24.2 зображено моделі чотирьох атомів, які позначені літерами А, Б, В та Г, причому атоми А і В — це атоми одного нукліда, атоми Б — другого, а атоми Г — третього.
Поміркуйте
Чи можна, на вашу думку, позначати нукліди так само, як і хімічні елементи?
Ні, не можна. Атоми одного хімічного елемента мають однакове число протонів, але можуть різнитися кількістю нейтронів, що додатково відображається значенням масового числа у вигляді верхнього індекса біля символу хімічного елемента.
Поміркуйте
Запропонуйте математичну модель визначення числа субатомних частинок в атомі певного хімічного елемента за відомим масовим числом.
Атом містить однакову кількість протонів і електронів, яка дорівнює порядковому номеру хімічного елемента.
Кількість нейтронів у будь–якому атомі становить різницю між масовим числом і кількістю протонів:
N = A – Z, де N — нейтронне число, А — масове число, Z — протонне число.
Поміркуйте
Скільки, на вашу думку, різних атомів може існувати в природі?
Будь–який вид атомів називають нуклідом. Загальна кількість відомих нині нуклідів становить понад 3000, з них, близько 300 є природними.
Поміркуйте
Чи можна впевнено стверджувати: «оскільки відомо 118 хімічних елементів, то в природі існує 118 різновидів атомів»?
Ні, не можна. У природі більшість хімічних елементів представлені кількома ізотопами, тобто є різними за складом ядра різновидами атомів одного й того самого хімічного елемента.
Поміркуйте
Грецькою мовою ізос означає «рівний, однаковий, подібний», а топос означає «місце». Що, на вашу думку, означає термін «ізотоп»?
Термін походить від грецьких слів «ізос» — однаковий і «топос» — місце. Ізотопам як видам атомів хімічного елемента «належить» одна клітинка періодичної таблиці.
Вправа 300
У додаткових джерелах знайдіть інформацію про дослідження науковців і науковець, які зробили важливі відкриття в історії атомної теорії (Дж. Дальтон, Дж. Дж. Томсон, Е. Резерфорд, Н. Бор тощо, про одного на власний вибір). Підготуйте доповідь.
Англійський фізик і хімік Джон Дальтон (1766-1844) у 1803 році розвинув теорію, за якою припускав, що всі речовини складаються з атомів — неподільних частинок, які мають певну масу й не можуть зникати або змінюватися під час хімічних реакцій. Ця теорія існувала приблизно 100 років. І тільки на початку ХХ століття науковці довели, що атом має складну будову.
--------------------------------------------------------------
Англійський фізик Джозеф Джон Томсон (1856–1940) у 1897 році відкрив у складі атома електрони і запропонував першу модель будови атома, що дістала назву «кексова» модель. За цією моделлю атом має форму кулі, а позитивно заряджені частинки рівномірно розподілені по всьому об’єму кулі, в яку вкраплені негативно заряджені частинки — електрони. Маса атома рівномірно розподілена в цьому об’ємі і атом у цілому нейтральний.
Модель Томсона проіснувала в науці недовго. Через кілька років її спростував англійський фізик Ернест Резерфорд.
-------------------------------------------------------
Англійський фізик Ернест Резерфорд (1871–1937) у 1909 році провів відомий експеримент із золотою фольгою, результати досліду якого спростували «кексову» модель Дж. Томсона, що існувала на той час, бо доводили, що атоми складаються з невеликої позитивно зарядженої частини, що міститься в центрі атома, названа вченим — ядром, та негативно заряджених частинок — електронів, розміщених поза його межами. У 1911 р. Е. Резерфорд запропонував нову модель будови атома, що дістала назву планетарної, бо подібна на модель Сонячної системи. За цією моделлю весь позитивний заряд і майже вся маса атома зосереджена в атомному ядрі, розмір якого надзвичайно малий у порівнянні з розмірами атома, а навколо ядра, безупинно рухаються електрони.
У 1919 р. Е.Резерфорд під час експериментальних досліджень здійснив розщеплення ядра й відкрив протони — позитивно заряджені частинки, за рахунок яких ядро має позитивний заряд.
Ернест Резерфорд став лауреатом Нобелівської премії у 1908 р.
-------------------------------------------------------------------
Датський фізик Нільсон Бор (1885-1962) у 1913 році в своїй теорії будови атома пояснив, що електрони можуть обертатися не на будь-якій орбіті, а тільки на визначених відстанях від ядра, а певними стаціонарними орбітами, утворюючи концентричні сфери з електронів. Тому іноді планетарну модель атома називають моделлю Бора–Резерфорда.
Вправа 301
Із частинок, із яких складаються атоми, лише електрон називають елементарною частинкою. Інші — протони й нейтрони — називають субатомними частинками. Із додаткових джерел дізнайтеся, які частинки називають елементарними та чому протони й нейтрони не вважають такими.
Елементарна частинка — це частинка без внутрішньої структури, тобто не містить інших частинок у своєму складі. Електрони не мають у своєму складі інших частинок, в той час, як протони й нейтрони складаються з кварків. Ось чому електрони називають елементарними частинками, а протони й нейтрони не вважаються такими.
Вправа 302
У додаткових джерелах знайдіть інформацію про «рекорди» нуклідів. У якого хімічного елемента відомо найбільше нуклідів, у якого — найбільше природних нуклідів? А в яких — найменше?
Рекордсменами за числом нуклідів є Ксенон і Цезій: кожен з них існує у вигляді 36 нуклідів, але більшість із них є нестабільними. Рекордсменом за числом природних нуклідів, яких налічується 10, є Станум. А деякі хімічні елементи мають лише один природний нуклід, наприклад, Флуор (19F), Натрій (23Na), Алюміній (27Al), Фосфор (31P).
Вправа 303
У природних речовинах на Землі знайдено 92 хімічні елементи, проте в Періодичній таблиці наведено 118. У додаткових джерелах знайдіть інформацію про те, як дізналися про існування хімічних елементів, які не існують у природних речовинах. Який хімічний елемент, з–поміж таких, яких немає на Землі, було відкрито першим? Чи можуть бути відкриті ще нові хімічні елементи?
Хімічні елементи, які не існують у природних речовинах, були відкриті в лабораторних умовах під час проведення ядерних реакцій. Більшість з них нестабільні й радіоактивні. Першим штучно отриманим хімічним елементом був Технецій (Tc, атомний номер 43), відкритий у 1937 році.
Очевидно, що можуть бути штучно відкриті ще нові хімічні елементи, бо наразі ще не досягнена межа стійкості атомів. Відкриття радіоактивних елементів відбувалося з використанням унікального експериментального обладнання і приладів, які давали змогу виявляти частинки, тривалість «життя» яких становила долі секунди.
Вправа 304
Порівняйте поняття, склавши для них діаграми Венна:
а) «атом» і «хімічний елемент»;
|
Діаграма Венна
|
|
Відмінне
|
Спільне
|
Відмінне
|
|
Атом
|
Хімічний елемент
|
|
Матеріальна частинка
(має масу, розмір, будову),
перегруповуються в хімічних
реакціях
|
Фундаментальні
поняття хімії
|
поняття класифікації
певного виду атомів,
міститься в Періодичній
таблиці
|
б) «електрон» і «протон»;
|
Діаграма Венна
|
|
Відмінне
|
Спільне
|
Відмінне
|
|
Електрон
|
Протон
|
|
Негативно заряджений (–1),
найлегший за масою,
в складі електронної
оболонки атома.
|
Субатомні частинки,
в складі атома.
|
Позитивно заряджений (+1),
1 а.о.м.,
в складі ядра атома
|
в) «протон» і «нейтрон».
|
Діаграма Венна
|
|
Відмінне
|
Спільне
|
Відмінне
|
|
Протон
|
Нейтрон
|
|
Позитивно заряджений (+1)
|
Субатомні частинки,
в складі ядра атома,
є нуклонами, маси
майже однакові 1 а.о.м.
|
Не має заряду (0)
|
Вправа 305
Атом Карбону містить 6 електронів. Чому дорівнює заряд:
а) атома Карбону; У атомі Карбону кількість протонів і електронів однакова (6), а їхні заряди є рівними за величиною, але протилежними за знаком, тому сумарний заряд дорівнює нулю (6+(–6)=0) і атом є електронейтральним.
б) ядра атома Карбону? Весь позитивний заряд ядра зумовлений протонами, тому +6
Вправа 306
Запишіть позначення нукліда, якщо ядро атома містить:
а) 2 протони й 1 нейтрон;
Оскільки Z=2, N=1, тому A=Z+N=2+1=3, отже, позначення нукліда 32He.
б) 8 протонів і 9 нейтронів;
Оскільки Z=8, N=9, тому A=Z+N=8+9=17, отже, позначення нукліда 178О.
в) 15 протонів і 16 нейтронів;
Оскільки Z=15, N=16, тому A=Z+N=15+16=31, отже, позначення нукліда 3115Р.
г) 35 протонів і 45 нейтронів;
Оскільки Z=35, N=45, тому A=Z+N=35+45=80, отже, позначення нукліда 8035Br.
д) 25 протонів і 30 нейтронів;
Оскільки Z=25, N=30, тому A=Z+N=25+30=55, отже, позначення нукліда 5525Mn.
е) 89 протонів і 117 нейтронів.
Оскільки Z=89, N=117, тому A=Z+N=89+117=206, отже, позначення нукліда 20689Ac.
Вправа 307
Визначте склад атомів таких нуклідів:
І7O: Масове число А=17, протонів 8, електронів 8, нейтронів N=A–Z=17–8=9.
14С: Масове число А=14, протонів 6, електронів 6, нейтронів N=A–Z=14–6=8.
137Cs: Масове число А=137, протонів 55, електронів 55, нейтронів N=A–Z=137–55=82.
60Со: Масове число А=60, протонів 27, електронів 27, нейтронів N=A–Z=60–27=33.
І30І: Масове число А=130, протонів 53, електронів 53, нейтронів N=A–Z=130–53=77.
65Zn. Масове число А=65, протонів 30, електронів 30, нейтронів N=A–Z=65–30=35.
Вправа 308
Чим відрізняються за складом ядра атомів нуклідів:
а) Літію 6Li і 7Li;
Числом нейтронів (3 і 4 відповідно)
Z=3, число нейтронів для 6Li 6–3=3 і для 7Li 7–3=4.
б) Урану 235U і 239U?
Числом нейтронів (143 і 147 відповідно)
Z=92, число нейтронів для 235U 235–92=143 і для 239U 239–92=147.
Вправа 309
Визначте нуклід:
а) Натрію, який містить таке саме число нейтронів, що й нуклід 24Mg;
Для нукліда 24Mg: протонне число Z=12, масове число A=24, тоді нейтронів N=A–Z=24–12=12. Для нукліда Натрію: нейтронів N=12, протонне число Z=11, масове число A=Z+N=11+12=23, тому нуклід 23Na.
Відповідь: 23Na.
б) Оксигену, який містить таке саме число нейтронів, що й нуклід ІЗС.
Для нукліда 13С: протонне число Z=6, масове число A=13, тоді нейтронів N=A–Z=13–6=7. Для нукліда Оксигену: нейтронів N=7, протонне число Z=8, масове число A=Z+N=8+7=15, тому нуклід 15О.
Відповідь: 15О.
Вправа 310
Із наведеного переліку 168О, 146C, 147N, 126C, 157N, 158O виберіть:
а) ізотопи;
Ізотопами є нукліди з однаковим протонним числом, але різним масовим числом, тому ізотопами є нукліди Оксигену 168О і 158O, нукліди Карбону 146C і 126C, нукліди Нітрогену 147N і 157N.
б) нукліди з однаковим нейтронним числом;
Знайдемо нейтронне число кожного нукліду:
168О (16–8=8), 146C (14–6=8), 147N (14–7=7), 126C (12–6=6), 157N (15–7=8), 158O (15–8=7).
Отже, однакове нейтронне число мають нукліди: 168О, 146C, 157N і 147N, 158O.
в) нукліди з однаковим нуклонним числом.
Нуклонне число записують верхнім індексом, тому нуклідами з однаковим нуклонним числом є 146C, 147N і 157N, 158O.
Вправа 311
Нукліди єдиного елемента— Гідрогену— окрім позначень, ще і мають власні назви: звичайний Гідроген Н(11Н ) — Протій; важкий Гідроген D(21Н ) — Дейтерій і надважкий Гідроген T(31Н ) — Тритій. Удалося добути ще супернадважкий Гідроген (41H), але власної назви він ще не має. Проаналізуйте малюнок і схарактеризуйте відмінності нуклідів Гідрогену. Чому вони отримали такі назви?
На малюнку всі нукліди Гідрогену відрізняються кількістю нейтронів (0, 1, 2, й 3 відповідно), отже, мають різні нуклонні числа (1, 2, 3 й 4 відповідно). Свої назви вони отримали від грецьких слів «протос» (перший), «дейтерос» (другий) та «тритос» (третій), що вказує на їхні нуклонні числа — 1, 2 та 3 відповідно.
Вправа 312
Масові числа нуклідів — цілі числа. Проте для більшості хімічних елементів відносні атомні маси є дробовими числами, які часто суттєво відрізняються від цілого значення, наприклад Аr(Сl) = 35,453. Сформулюйте гіпотезу, яка пояснювала б цей факт. Знайдіть у додаткових джерелах інформацію, яка б підтверджувала або спростовувала вашу гіпотезу.
Те, що для більшості хімічних елементів відносні атомні маси є дробовими числам пояснюється тим, що більшість хімічних елементів трапляються в природі у вигляді суміші декількох ізотопів, і значення, наведене в Періодичній таблиці, є середнім, обчисленим з урахуванням умісту кожного ізотопа в природі.
Так, природний Хлор на 75,8% складається з атомів 35Cl і на 24,2% — з 37Cl, тому його атомна маса дорівнює 35,5.
Ar(Cl) = 35 • 0,758 + 37 • 0,242 = 35,453 ≈ 35,5
Цю гіпотезу підтверджують наукові джерела з хімії та фізики. В усіх Періодичних таблицях наведені середні відносні атомні маси, обчислені з урахуванням їхнього ізотопного складу. Отже, дробові значення пояснюються існуванням ізотопів та неоднаковою їхньою поширеністю в природі.
Вправа 313
Чи можливо, на вашу думку, за значенням відносної атомної маси хімічних елементів передбачити нукліди, якими представлений цей елемент у природі. Якщо відносна атомна маса Бору дорівнює 10,81, то які існують природні нукліди Бору?
Так, можна за значенням відносної атомної маси хімічних елементів передбачити нукліди, яким представлений цей елемент у природі. Оскільки відносна атомна маса Бору дорівнює 10,81, а масові числа нуклідів є цілими числами, то число 10,81 перебуває в проміжку цілих чисел 10 і 11, які є масовими числами для нуклідів Бору. Отже існують в природі нукліди 10В і 11В, з них, останній більш поширений.
Вправа 314
Нукліди можуть бути стабільними та нестабільними. Нестабільні нукліди піддаються радіоактивному розпаду, унаслідок чого виникає радіоактивне випромінювання. У додаткових джерелах знайдіть інформацію про види радіоактивного випромінювання та його вплив на живі організми.
Розрізняють такі види радіоактивного випромінювання: альфа (α) (потік ядер гелію), бета (β) (потік швидких електронів або позитронів) та гамма (γ) (електромагнітні хвилі високої енергії). Радіоактивне випромінювання іонізує молекули в клітинах живих організмів, що призводить до руйнування хімічних зв’язків між молекулами, пошкодження структури ДНК клітини та виникнення мутацій, розвитку променевої хвороби або онкологічних захворювань.
Вправа 315
Ґрунтуючись на значенні відносної атомної маси хімічних елементів, спрогнозуйте, у вигляді яких нуклідів існують у природі:
а) Літій;
Відносна атомна маса Літію Ar(Li) ≈ 6,94, найближчі цілі масові числа дорівнюють 6 і 7, отже, існують в природі нукліди 6Li і 7Li, з них, останній більш поширений.
б) Бор;
Відносна атомна маса Бору Ar(В) ≈ 10,81, найближчі цілі масові числа дорівнюють 10 і 11, отже, існують в природі нукліди 10В і 11В, з них, останній більш поширений.
в) Фосфор;
Відносна атомна маса Фосфору Ar(F) ≈ 30,97, найближче ціле масове число дорівнює 31, отже, існує в природі нуклід 31F.
г) Купрум.
Відносна атомна маса Купруму Ar(Cu) ≈ 63,55, найближчі цілі масові числа дорівнюють 63 і 64, отже, існують в природі нукліди 63Сu і 64Cu, з них, перший більш поширений.
Вправа 316
Як ви вважаєте, чому в Періодичній таблиці для більшості хімічних елементів відносні атомні маси є дробовими числами, а для радіоактивних елементів — цілими числами?
Хімічні елементи можуть мати як стабільні, так і нестабільні нукліди. Більшість атомів, що нас оточують, належать до стабільних нуклідів. Хімічні елементи, що не мають стабільних нуклідів, називають радіоактивними. Більшість радіоактивних елементів добуті штучно й у природі не трапляються, тому в Періодичній системі замість відносної атомної маси таких радіоактивних елементів зазначені масові числа найстабільніших з їхніх нуклідів.
Вправа 317
У молекулі води можуть міститися різні нукліди Гідрогену (1Н, 2Н, 3Н) та Оксигену (16О, 17О, 18О), утворюючи молекули з різною відносною молекулярною масою. Скільки різних молекул може утворитися із цих нуклідів: а) за складом; б) за масою?
Формула води — H2О. Значить, у молекулу можуть входити два будь–яких ізотопи атомів Гідрогену і один будь–який ізотоп атому Оксигену.
|
Молекули води (9 різновидів)
|
Значення маси (5 різних значень)
|
|
1Н1H16О, 2Н2H16О, 1Н2Н16О
1Н1H17О, 2Н2H17О, 1Н2Н17О
1Н1H18О, 2Н2H18О, 1Н2Н18О
|
18, 20, 19
19, 21, 20
20, 22, 21
|
Визначаємо масу для кожного різновиду молекули води.
Для молекули води 1Н1H16О значення маси дорівнює 18 а.о.м. (1+1+16=18),
Для молекули води 1Н1H17О значення маси дорівнює 19 а.о.м. (1+1+17=19),
Для молекули води 1Н1H18О значення маси дорівнює 20 а.о.м. (1+1+18=20),
для молекули води 2Н2H16О значення маси дорівнює 20 а.о.м. (2+2+16=20),
для молекули води 2Н2H17О значення маси дорівнює 21 а.о.м. (2+2+17=21),
для молекули води 2Н2H18О значення маси дорівнює 22 а.о.м. (2+2+18=22),
Для молекули води 1Н2H16О значення маси дорівнює 19 а.о.м. (1+2+16=19),
Для молекули води 1Н2H17О значення маси дорівнює 20 а.о.м. (1+2+17=20),
Для молекули води 1Н2H18О значення маси дорівнює 21 а.о.м. (1+2+18=21).
Відповідь: а) дев'ять, б) п'ять різних значень.
Вправа 318
Під час перегонки (дистиляції) великої кількості води на дні перегонного куба збирається небагато важкої води, утвореної Дейтерієм — нуклідом Гідрогену. Така вода D20 зовні схожа на звичайну воду, але відрізняється від неї властивостями. Вона замерзає не за 0°С, а за 3,8°С, перетворюючись на лід, який, на відміну від звичайного льоду, не плаває на поверхні води, а тоне. Важка вода не отруйна, але більшість тварин загине, якщо половину води в їхньому організмі замінити на важку. У важкій воді хімічні реакції відбуваються повільніше, що впливає на життєдіяльність організму. Проаналізуйте твердження та визначте, яке з них найкраще пояснює таку дію важкої води.
• Атоми Дейтерію радіоактивні, тому організм гине від опромінення.
• Важка вода щільніша, тому вона руйнує клітини організмів.
• У важкої води вища температура плавлення, тому за кімнатної температури вона замерзає.
• Атоми Дейтерію у два рази важчі за атоми Протію, тому організм стає важчим і гине від надмірної гравітації.
• Молекули важкої води мають більшу масу, тому хімічні реакції за її участі відбуваються повільніше.
Вправа 319
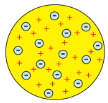
Установлення близької до сучасної моделі атома (планетарної) відбувалося низкою експериментальних і теоретичних досліджень. До появи планетарної моделі існували інші гіпотези щодо будови атома. Проаналізуйте різні моделі атомів на с. 236 і схарактеризуйте, чим вони відрізняються одна від одної.
1. «Кексова» модель атома Вільяма Томсона (1902), який уявляв атом як згусток позитивно зарядженої матерії, в якому рівномірно розподілені електрони, наче родзинки в кексі
Модель характеризується невпорядкованим розміщення електронів в кулі і зосередженням позитивного заряду по всьому об'єму.
2. «Кексова» модель, удосконалена Джозефом Джоном Томсоном (1904), у якій електрони розміщені в одній площині й утворюють концентричні кільця
Модель характеризується впорядкованим розміщення електронів на кільцях в одній площині, і зосередженням позитивного заряду по всьому об'єму.
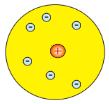
3. Модель атома Хантаро Нагаока (1904), який припустив, що атом схожий на планету Сатурн: половину об'єму займає позитивно заряджена куля, навколо якої супутники–електрони утворюють кільце
Модель характеризується впорядкованим розміщення електронів на кільцях в одній площині, і зосередженням позитивного заряду в центрі, займаючи половину об'єму.
Вправа 320
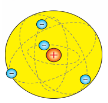
Планетарну модель атома запропонував 1909 року Ернест Резерфорд, здійснивши експеримент, у якому він бомбардував золоту фольгу «а–частинками (ядрами атомів 4Не). Науковець виявив, що більшість а–частинок вільно проходить крізь шар золота, а деякі частинки відхиляються від початкової траєкторії. Проаналізуйте малюнок і опишіть сутність цього експерименту. За результатами експерименту Е.Резерфорд відкинув усі попередні гіпотези та висловив свою. Проаналізуйте малюнок і поясніть міркування науковця, за якими він запропонував свою планетарну модель.
Поведінку надзвичайно малої кількості позитивно заряджених альфа–частинок, що відскакували назад, вчений пояснив так: оскільки частинки мали позитивний заряд, то відштовхувати (відкидати назад) їх могли інші частинки — також позитивно заряджені. Такі результати досліду поставили під сумнів модель Томсона, бо доводили, що більшість атомного простору не має позитивного заряду, а він сконцентрований у центрі в дуже малому об’ємі. На цій підставі вчений зробив висновок, що атоми складаються з позитивно зарядженого ядра, та негативно заряджених частинок — електронів, розміщених за його межами, тому запропонував у 1911 р. нову модель будови атома, що дістала назву планетарної.
Обговоріть питання щодо експерименту Е. Резерфорда.
• Яке значення золотої фольги й а–частинок для проведення цього експерименту?
Оскільки альфа–частинки заряджені позитивно, то для того щоб відштовхнутися від фольги, вони мають стикатися з іншими позитивно зарядженими частинками у складі атомів, які утворюють тонку золоту фольгу.
• Чому важливо було використовувати саме тонку золоту фольгу?
Щоб одержати шари золота завтовшки декілька атомів.
• Які результати експерименту були несподіваними?
Більшість із альфа–частинок, проходячи крізь фольгу, не відхилялися від початкового напрямку, деякі трохи відхилялися, а невелика кількість значно відхилялася від початкової траєкторії й іноді навіть летіла у зворотному напрямку, що було несподіваним.
• Чому більшість а–частинок пройшли крізь фольгу без відхилення?
Бо позитивний заряд сконцентрований в дуже невеликому об’ємі ядра атома.
• Як можна пояснити той факт, що деякі а–частинки відхилялися під великими кутами або навіть поверталися назад?
Чим ближче до ядра пролітали альфа–частинки, тим сильніше викривлялася їхня траєкторія, а частинки, що влучили прямо в ядро, відштовхувалися від нього й летіли назад.
• Чим планетарна модель атома Е. Резерфорда відрізняється від моделі Дж. Дж. Томсона? У чому її переваги?
У планетарній моделі атома Е. Резерфорда в центрі атома міститься крихітне позитивно заряджене ядро, в якому зосереджена майже вся маса атома, а навколо нього певними орбітами рухаються електрони, наче планети навколо Сонця, тоді як модель Дж. Дж. Томсона є удосконаленням «кексової», в якій залишилося уявлення, що позитивний заряд міститься у всьому об'ємі атома. Перевага планетарної моделі полягає в тому, що вона пояснювала результати дослідів із розсіюванням альфа–частинок, що позитивний заряд сконцентрований у центрі атома в дуже невеликому об’ємі, який Е. Резерфорд назвав ядром.
• Як Е. Резерфорд міг перевірити достовірність отриманих даних?
Тонка золота фольга була оточена екраном, який дозволив виявити відхилені частинки.
• Як результати цього експерименту пов'язані з явищами, які ми спостерігаємо у Всесвіті (наприклад, у зорях)?
Відкриття атомного ядра стало ключем до розуміння явищ, що відбуваються у зорях, оскільки в їх ядрах відбуваються термоядерні реакції, які відтворюють учені в термоядерних реакторах під час своїх досліджень. Ці реакції є джерелом енергії зірок і пояснюють утворення хімічних елементів у Всесвіті та процесів, які відбуваються.
_______________Видання 2021 і 2016 років_________________________
§6 2021 / §9 2016 СКЛАД АТОМІВ: ЯДРО ТА ЕЛЕКТРОНИ
Контрольні запитання
Запитання 1
Схарактеризуйте планетарну модель атома Резерфорда.
Атом складається з позитивно зарядженого ядра, в якому зосереджена основна частина маси атома, навколо якого по замкнутих орбітах обертаються негативно заряджені електрони.
Запитання 2
Які частинки містяться у складі:
а) атома
Електрони, протони і нейтрони.
б) атомного ядра
Протони і нейтрони.
Які в них заряд і маса?
|
Елементарна
частинка
|
Заряд
|
Маса
|
|
електрон
|
–1
|
0 а.о.м.
|
|
протон
|
+1
|
1 а.о.м.
|
|
нейтрон
|
0
|
1 а.о.м.
|
Запитання 3
Ядро атома:
а) має негативний заряд
б) позитивний заряд
в) не має заряду
Запитання 4
Як визначити число протонів у ядрі атома:
а) за порядковим номером елемента в Періодичній системі;
б) за номером періоду;
в) за номером групи
Запитання 5
Які характеристики атома вам відомі?
Заряд ядра атома, число електронів, атомна маса.
Як їх можна визначити?
Ядро атома має позитивний заряд, величина якого визначається порядковим номером елемента в Періодичній системі.
Кількість електронів в атомі також визначається порядковим номером елемента в Періодичній системі.
Майже вся маса атома зосереджена в його ядрі, тому атомна маса дорівнює сукупній масі протонів і нейтронів.
Запитання 6
Дайте визначення поняттям «атом» і «хімічний елемент».
Атоми — це найдрібніші електронейтральні частинки речовини, які складаються з позитивно зарядженого ядра й негативно заряджених електронів, що рухаються навколо ядра.
Хімічний елемент — це різновид атома з певним зарядом ядра.
Завдання для засвоєння матеріалу
Вправа 1
Ядро атома Гелію має заряд +2. Скільки електронів містить атом Гелію?
Два електрони, оскільки будь–який атом є електронейтральним, тому число протонів (заряд ядра атома) завжди дорівнює числу електронів.
Вправа 2
Атом Карбону містить 6 електронів. Чому дорівнює заряд:
а) атома Карбону
Атом електронейтральний, тому його заряд дорівнює 0
б) ядра атома Карбону? +6
Вправа 3
Визначте число протонів в ядрах і заряди ядра атомів:
а) Літію
Порядковий номер Літію 3, тому протонів 3, а заряд ядра +3
б) Сульфуру
Порядковий номер Сульфуру 16, тому протонів 16, а заряд ядра +16
в) Феруму
Порядковий номер Феруму 26, тому протонів 26, а заряд ядра +26
г) Плюмбуму.
Порядковий номер Плюмбуму 82, тому протонів 82, а заряд ядра +82
Прядковий номер елемента вказує на число протонів, а число протонів в ядрі атома дорівнює заряду ядра зі знаком +.
Вправа 4
Визначте заряд ядра, число електронів та масу атома і назвіть відповідні хімічні елементи, якщо атомне ядро містить:
а) 8 протонів і 9 нейтронів
Заряд ядра +8, бо дорівнює числу протонів у ядрі. Число електронів 8, бо дорівнює числу протонів.
Маса атома дорівнює сумі мас протонів і нейтронів, тому 8 а.о.м + 9 а.о.м.=17 а.о.м.
Число протонів дорівнює порядковому номеру елемента (№8) — це Оксиген.
6) 25 протонів і З0 нейтронів
Заряд ядра +25, бо дорівнює числу протонів у ядрі. Число електронів 25, бо дорівнює числу протонів.
Маса атома дорівнює сумі мас протонів і нейтронів, тому 25 а.о.м + 30 а.о.м.=55 а.о.м.
Число протонів дорівнює порядковому номеру елемента (№25) — це Манган.
в) 89 протонів і 117 нейтронів
Заряд ядра +89, бо дорівнює числу протонів у ядрі. Число електронів 89, бо дорівнює числу протонів.
Маса атома дорівнює сумі мас протонів і нейтронів, тому 89 а.о.м + 117 а.о.м.=206 а.о.м.
Число протонів дорівнює порядковому номеру елемента (№89) — це Актиній.
Вправа 5*
Опишіть суть експерименту Резерфорда з визначення будови атома.
У 1909 р. здійснив експеримент, у якому бомбардував золоту фольгу позитивно зарядженими альфа–частинками. Більшість із них, проходячи крізь фольгу, не відхилялися від початкового напрямку, деякі трохи відхилялися, а невелика кількість альфа–частинок значно відхилялися від початкової траєкторії й іноді навіть летіли у зворотному напрямку.
Які результати цього досліду дозволили йому зробити висновки про планетарну будову атома?
У ході експеримента чим ближче до ядра пролітали альфа–частинки, тим сильніше викривлялася їхня траєкторія, а частинки, що влучили прямо в ядро, відштовхувалися від нього й летіли назад. На підставі результатів цього досліду Резерфорд довів, що позитивний заряд сконцентрований у центрі атома в дуже невеликому об’ємі, який назвав ядром. Ядро оточене негативно зарядженими електронами.
––––––––––––––– ПРОГРАМА 2016 року –––––––––––––––––
Завдання 7 Наведіть сучасне формулювання Періодичного закону.
Властивості хімічних елементів, а також утворених ними речовин перебувають у періодичній залежності від зарядів їхніх атомних ядер.
Чим воно відрізняється від того, що ви вивчали раніше? Властивості хімічних елементів, а також утворених ними речовин перебувають у періодичній залежності від зарядів їхніх атомних ядер, а не від значення відносних атомних мас, як ми вивчали раніше.
Інші завдання дивись тут...