Інші завдання дивись тут...
© 8next.com (відповіді, перероблене і доповнене)
Поміркуйте
По скільки орбіталей містять різні енергетичні рівні та по скільки електронів можуть максимально вміщувати енергетичні рівні: перший, другий, третій тощо?
Кожний енергетичний рівень може максимально вміщувати 2n² електронів і містить n² орбіталей. Відповідно, перший енергетичний рівень містить одну (1² = 1) орбіталь з максимальною кількістю електронів 2 (2•11=2), другий енергетичний рівень — чотири (2²=4) орбіталі з максимальною кількістю 8 (2•2²=8) електронів, третій енергетичний рівень — дев'ять (3²=9) орбіталей з максимальною кількістю 18 (2•3²=18) електронів.
Поміркуйте
Які електрони мають меншу енергію: ті, які перебувають на енергетичному рівні, ближчому до ядра, чи навпаки?
Електрони займають енергетичні рівні послідовно, починаючи з першого енергетичного, у порядку збільшення енергії, тому меншу енергію мають ті електрони, які перебувають на енергетичному рівні, що розташований ближче до ядра атома.
Поміркуйте
Якщо другий енергетичний рівень може максимально вміщувати 8 електронів, то в якого хімічного елемента другий рівень заповниться повністю?
Другий енергетичний рівень заповниться повністю в атомі хімічного елемента з порядковим номером 10 — це Неон.
Поміркуйте
Як ви вважаєте, який рівень називають зовнішнім?
Зовнішнім рівнем називають останній енергетичний рівень в атомі, на якому ще розташовані електрони.
Поміркуйте
Якою буде енергія електронів на зовнішньому енергетичному рівні порівняно з іншими електронами цього атома: найбільшою чи найменшою?
Електрони займають енергетичні рівні послідовно, починаючи з першого енергетичного, у порядку збільшення енергії, тому на на зовнішньому енергетичному рівні енергія електронів буде найбільшою.
Для електронних оболонок, моделі яких наведено вище в цьому параграфі, визначте число електронів на зовнішньому енергетичному рівні.
У електронній оболонці атома Гідрогену на зовнішньому енергетичному рівні міститься 1 електрон, атома Гелію — 2 електрони, атома Літію — 1 електрон, атома Берилію — 2 електрони, атома Бору — 3 електрони, атома Карбону — 4 електрони, атома Неону — 8 електронів, атома Натрію — 1 електрон, атома Аргону — 8 електронів, атома Калію — 1 електрон.
ДОСЛІДЖУЄМО, МОДЕЛЮЄМО, ПРОЄКТУЄМО
Використовуючи підручні матеріали (дроти, намистини, канцелярські скріпки тощо), створіть статичну 2D– або 3D–модель атома (на вибір із перших 20 хімічних елементів) з урахуванням розподілу електронів по енергетичних рівнях.
Для створення 2D–моделі атома скористаємося кульками, зробленими з пластиліну, для зображення ядра і електронів, а також кільцями різного радіусу, зробленими з дроту, для зображення енергетичних рівнів.
2D–модель атома Натрію на площині матиме вигляд: пластилінове ядро в центрі та три концентричні кільця з дроту як енергетичні рівні: на першому (найближчому до ядра) містяться 2 кульки–електрони, на другому — 8 кульок–електронів, а на третьому (зовнішньому)— 1 кулька–електрон.
Поміркуйте
Порівняйте максимальну місткість енергетичних рівнів і число хімічних елементів у кожному періоді.
В атомах елементів 1–ї та 2–ї груп число електронів на зовнішньому рівні дорівнює номеру групи. В атомах елементів 13–18 груп, за винятком хімічного елемента 1 періоду Гелію (Не), число електронів на зовнішньому рівні дорівнює номер групи мінус 10.
Вправа 321
Скільки електронів міститься на зовнішньому енергетичному рівні атомів:
а) Гелію;
Інертний елемент 1 періоду, тому має 2 електрони на зовнішньому енергетичному рівні.
б) Літію;
Елемент 1–ї групи, тому має 1 електрон на зовнішньому енергетичному рівні.
в) Берилію;
Елемент 2–ї групи, тому має 2 електрони на зовнішньому енергетичному рівні.
г) Бору;
Елемент 13–ї групи, тому має 3 електрони на зовнішньому енергетичному рівні.
д) Карбону;
Елемент 14–ї групи, тому має 4 електрони на зовнішньому енергетичному рівні.
е) Оксигену;
Елемент 16–ї групи, тому має 6 електронів на зовнішньому енергетичному рівні.
є) Арсену;
Елемент 15–ї групи, тому має 5 електронів на зовнішньому енергетичному рівні.
ж) Стануму;
Елемент 14–ї групи, тому має 4 електрони на зовнішньому енергетичному рівні.
з) Барію?
Елемент 2–ї групи, тому має 2 електрони на зовнішньому енергетичному рівні.
Вправа 322
Скільки енергетичних рівнів зайнято електронами в атомах:
а) Карбону, Силіцію, Германію;
Ці елементи містяться в 2–му, 3–ому і 4–му періодах відповідно, тому й електронами зайнято 2–ий, 3–ій і 4–ий енергетичні рівні відповідно.
б) Берилію, Магнію, Кальцію;
Ці елементи містяться в 2–му, 3–ому і 4–му періодах відповідно, тому й електронами зайнято 2–ий, 3–ій і 4–ий енергетичні рівні відповідно.
в) Флуору, Хлору, Йоду?
Ці елементи містяться в 2–му, 3–ому і 4–му періодах відповідно, тому й електронами зайнято 2–ий, 3–ій і 4–ий енергетичні рівні відповідно.
Вправа 323
Назвіть два хімічні елементи, в атомах яких повністю заповнені зовнішні енергетичні рівні.
Повністю заповнені зовнішні енергетичні рівні в атомах інертних елементів 18–ої групи, тому можна назвати два елементи: Неон (Ne) і Аргон (Ar).
Вправа 324
Для хімічних елементів № 1–20 визначте: а) число електронних пар на зовнішньому енергетичному рівні; б) число неспарених електронів на зовнішньому енергетичному рівні.
|
№
|
Хімічний
елемент
|
Г
р
у
п
а
|
На зовнішньому енергетичному рівні
|
|
Кількість
електронів
|
а) електрон–
них пар
|
б) неспарених
електронів
|
| 1 |
H |
1 |
1 |
– |
1 |
| 2 |
He |
2 |
2 |
1 |
– |
| 3 |
Li |
1 |
1 |
– |
1 |
| 4 |
Be |
2 |
2 |
1 |
– |
| 5 |
B |
13 |
3 |
1 |
1 |
| 6 |
C |
14 |
4 |
2 |
– |
| 7 |
N |
15 |
5 |
2 |
1 |
| 8 |
O |
16 |
6 |
3 |
– |
| 9 |
F |
17 |
7 |
3 |
1 |
| 10 |
Ne |
18 |
8 |
4 |
– |
| 11 |
Na |
1 |
1 |
– |
1 |
| 12 |
Mg |
2 |
2 |
1 |
– |
| 13 |
Al |
13 |
3 |
1 |
1 |
| 14 |
Si |
14 |
4 |
2 |
– |
| 15 |
P |
15 |
5 |
2 |
1 |
| 16 |
S |
16 |
6 |
3 |
– |
| 17 |
Cl |
17 |
7 |
3 |
1 |
| 18 |
Ar |
18 |
8 |
4 |
– |
| 19 |
K |
1 |
1 |
– |
1 |
| 20 |
Ca |
2 |
2 |
1 |
– |
Завдання 325
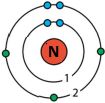
Зобразіть будову електронних оболонок атомів Нітрогену та Фосфору. Що спільного в будові електронних оболонок цих атомів і чим вони відрізняються?
| Нітроген |
Фосфор |
 |
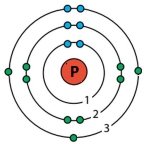 |
Спільним є число електронів (5) на зовнішньому енергетичному рівні.
Відрізняються числом енергетичних рівнів в електронній оболонці (2 і 3 відповідно).
Вправа 326
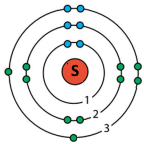
Які хімічні елементи є електронними аналогами Оксигену? Зобразіть будову електронної оболонки атома одного з них.
Електронними аналогами Оксигену є атоми хімічних елементів 16–ої групи: Сульфур, Селен, Телур.
| Cульфур |
 |
Вправа 327
Порівняйте ознаки хімічних елементів (металічний чи неметалічний) із числом електронів на зовнішньому рівні атомів. Сформулюйте гіпотезу щодо виявленої вами закономірності.
Атоми металічних елементів мають на зовнішньому енергетичному рівні невелику кількість електронів (зазвичай від 1 до 3), а неметалічних — більшу (від 4 до 8). Гіпотеза: металічні та неметалічні властивості елементів залежать від кількості електронів на зовнішньому енергетичному рівні атома: чим менша кількість електронів, тим легше віддавати, що характерно для металів, а чим більша кількість електронів, тим легше приєднувати, що притаманно неметалам.
_______________Видання 2021 і 2016 років_________________________
§7 2021 / §10 2016 ХІМІЧНИЙ ЕЛЕМЕНТ: НУКЛІДИ
Контрольні запитання
Запитання 1
Дайте визначення поняття «нуклід».
Нуклід — це різновид атомів із певним числом протонів і нейтронів в ядрі.
Запитання 2
Чим відрізняються стабільні й нестабільні нукліди?
Стабільні нукліди, на відміну від нестабільних, існують протягом нескінченно довгого часу.
Наведіть приклади стабільних і нестабільних нуклідів.
Усі "парні" елементи мають стабільні нукліди, а також більшість "непарних" із протонним числом меншим 84. Стабільними є нукліди Оксигену, Карбону. Хімічні елементи, що не мають стабільних нуклідів, називають радіоактивними. До них належать усі елементи, що розташовані в Періодичній системі за Бісмутом, а також Технецій і Прометій.
Запитання 3
Як визначити число протонів, нейтронів та електронів в атомі?
На число протонів у ядрі атома вказує порядковий номер елемента.
Число нейтронів є різницею відносної атомної маси елемента і числом протонів (порядковий номер елемента).
Число електронів дорівнює числу протонів, або порядковому номеру елемента.
Завдання для засвоєння матеріалу
Вправа 1
Ядро атома хімічного елемента містить два протони й один нейтрон. Запишіть позначення цього атома: укажіть хімічний символ, порядковий номер і масове число.
За умовою число протонів Z=2 i число нейтронів N=1, тому масове число А=Z+N=2+1=3, отже, 32Не, порядковий №2, масове число А=3
Вправа 2
Скільки протонів і нейтронів містять ядра
17О : протонів Z=8, нейтронів N=17–8=9
14С : протонів Z=6, нейтронів N=14–6=8
137Cs : протонів Z=55, нейтронів N=137–55=82
Порядковий номер елемента вказує на число протонів (Z).
Число нейтронів (N)=масове (нуклонне) число – число протонів (Z).
Вправа 3
Чим відрізняються за своїм складом ядра атомів нуклідів:
а) Літію 6Li та 7Li
Числом нейтронів, оскільки число протонів (порядковий номер) однакове, а різним є нуклонне число.
б) Урану 235U та 239U
Числом нейтронів, оскільки число протонів (порядковий номер) однакове, а різним є нуклонне число.
Вправа 4
Який нуклід Натрію містить таке саме число нейтронів, що й нуклід 24Мg? Число нейтронів у нукліді 24Мg обчислимо як різницю між нуклонним числом (А=24) і числом протонів Z (показує порядковий номер елемента) N=А–Z=24–12=12. Обчислимо нуклонне число Натрію, що містить таке саме число нейтронів: A=N+Z=12+11=23, отже, це нуклід 23Na.
Вправа 5
Назвіть елементи і напишіть позначення нуклідів, ядра атомів яких містять:
а) 2 протони і 2 нейтрони
За умовою Z=2 i N=2, тому нуклонне число A=Z+N=2+2=4, тому Гелій 42Не
б) 15 протонів і 16 нейтронів
За умовою Z=15 i N=16, тому нуклонне число A=Z+N=15+16=31, тому Фосфор 3115Р
в) 35 протонів і 45 нейтронів. Напишіть позначення цих нуклідів.
За умовою Z=35 i N=45, тому нуклонне число A=Z+N=35+45=80, тому Бром 8035Br
Вправа 6
Із наведеного переліку виберіть:
а) нукліди з однаковим нейтронним числом:
Число нейтронів=нуклонне число–число протонів, тобто
16–8=8, 14–6=8, 14–7=7, 12–6=6, 15–7=8, тому маємо:
168O, 146С, 157N
б) Нукліди одного елемента
146С, 126С; 147N, 157N; 168O
в) нукліди з однаковим нуклонним числом
У нукліді нуклонне число пишуть ліворуч угорі від символу хімічного елемента, тому маємо:
146С, 147N
Вправа 7
Скільки різних видів молекул води може бути утворено з трьох нуклідів Гідрогену і трьох нуклідів Оксигену?
Три нукліди Гідрогену (1Н, 2Н, 3Н) і три нукліди Оксигену (16О, 17О, 18О)
Формула води — H2О. Значить, у молекулу можуть входити два будь–яких ізотопи атомів Гідрогену і один будь–який ізотоп атому Оксигену. Розглянемо можливі варіанти молекул води:
1Н1H16О, 2Н2H16О, 3Н3H16О
1Н1H17О, 2Н2H17О, 3Н3H17О
1Н1H18О, 2Н2H18О, 3Н3H18О
Відповідь: молекул води може бути дев'ять.
Вправа 8
Відносна атомна маса Бору становить 10,81. Як ви вважаєте, у вигляді яких нуклідів існує Бор у природі? Оскільки маси кожного протона і нейтрона дорівнюють приблизно 1 а.о.м., а маса електрона мізерна, то масове число (нуклонне число) кожного атома приблизно дорівнює його відносній атомній масі, округленій до цілих чисел, тому Бор існує у вигляді двох нуклідів 115В, 105В.
–––––––––––––––––––––––––––– ПРОГРАМА 2016 року –––––––––––––––––––––––––––––––––
Запитання 1. Дайте визначення понять «нуклід» та «ізотоп».
Нуклід — це різновид атомів із певним числом протонів і нейтронів в ядрі.
Ізотопи — це різні нукліди одного хімічного елемента.
Запитання 3. Ізотопи відрізняються один від одного:
а) числом протонів
б) числом нейтронів
в) числом електронів
Запитання 5. Назвіть ізотопи Гідрогену. Н (11H)— Протій, D (21H)— Дейтерій, Т (31H ) — Тритій
Чим вони відрізняються? Числом нейтронів. Протій не має нейтронів, Дейтерій має 1 нейтрон, а Тритій — 2 нейтрони.
Вправа 6. Із наведеного переліку виберіть:
а) ізотопи
Ізотопи — це нукліди, які мають однаковий заряд ядра, але різні нуклонні числа, тому маємо:
146С, 126С; 147N, 157N
б) нукліди з однаковим нейтронним числом
Число нейтронів=нуклонне число–число протонів, тобто
16–8=8, 14–6=8, 14–7=7, 12–6=6, 15–7=8, тому маємо:
168O, 146С,157N
в) нукліди з однаковим нуклонним числом
У нукліді нуклонне число пишуть ліворуч угорі від символу хімічного елемента, тому маємо:
146С, 147N
Вправа 9. Телур у Періодичній системі має менший номер, ніж Йод, проте його відносна атомна маса більша. Поясніть цей факт. Відносна атомна маса хімічного елемента (Ar) — величина, що дорівнює відношенню середнього значення мас усіх його природних ізотопів, з урахуванням їх поширеності, до 1/12 маси атома Карбону 12C, то очевидно, що в Телура наявна більша кількість важких ізотопів.
Інші завдання дивись тут...