![]()
Контрольні запитання
Запитання 1
Скільки електронів може максимально перебувати на одній електронній орбіталі? Два електрони, що мають однакову енергію, але антипаралельні (протилежні) спіни.
Запитання 2
Скільки електронів максимально може перебувати на:
s-підрівні?
Два електрони, бо має 1 орбіталь, на якій максимально може бути 2 електрони.
p-підрівні?
Шість електронів, бо має 3 орбіталі, на якій максимально може бути 2 електрони.
d-підрівні?
Десять електронів, бо має 5 орбіталів, на якій максимально може бути 2 електрони.
Запитання 3
Який енергетичний рівень заповнюється раніше: перший чи другий? Перший.
Відповідь поясніть. Енергетичні рівні заповнюються за принципом найменшої енергії: електрони займають орбіталі послідовно, починаючи з першого енергетичного рівня, у порядку збільшення енергії рівня.
Запитання 4
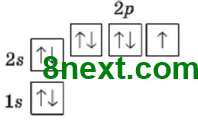
Чому в атомі Літію електрон, що міститься на другому електронному рівні, перебуває на s-орбіталі, а не на р-орбіталі? Згідно з принципом найменшої енергії кожний електрон розташовується в такий спосіб, щоб його енергія була найменшою, а s-орбіталь має меншу енергію, ніж р-орбіталь.
Запитання 5
Як розподіляються електрони по орбіталях на р-підрівні? Електрон займає вільну орбіталь, а за відсутності вільної – утворює пару з іншим електроном у напівзаповненій орбіталі. Іншими словами за правилом Хунда: у межах одного енергетичного підрівня електрони розподіляються по орбіталях таким чином, щоб число неспарених електронів було максимальним.
Запитання 6
Скільки електронів міститься на зовнішньому енергетичному рівні атомів:
а) Гелію
Два електрони
б) Літію
Один електрон
в) Берилію
Два електрони
г) Бору
Три електрони
д) Карбону
Чотири електрони
е) Оксигену
Шість електронів
Для елементів головних підгруп на кількість електронів на зовнішньому енергетичному рівні вказує номер групи, в якій розміщений елемент. Винятком є Гелій, атом має два електрони, але є елементом VIII групи Періодичної системи.
Запитання 7
Скільки енергетичних рівнів зайнято електронами в атомах:
а) Літію, Натрію, Калію
Два, три, чотири енергетичні рівні
б) Берилію, Магнію, Кальцію
Два, три, чотири енергетичні рівні
в) Флуору, Хлору, Брому
Два, три, чотири енергетичні рівні
Кількість енергетичних рівнів співпадає з номером періоду, в якому розміщений хімічний елемент.
Завдання для засвоєння матеріалу
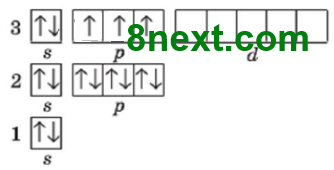
Вправа 1
Складіть графічну електронну формулу Нітрогену, Флуору, Магнію, Алюмінію та Силіцію. Визначте число електронних пар та неспарених електронів на зовнішньому енергетичному рівні.
|
Нітроген
електронних пар: 1 неспарених електронів: 3 |
|
Флуор
електронних пар: 3 неспарених електронів: 1 |
|
Магній
електронних пар: 1 неспарених електронів: 0 |
|
Алюміній
електронних пар: 1 неспарених електронів: 1 |
|
Силіцій
електронних пар: 1 неспарених електронів: 2 |
Вправа 2
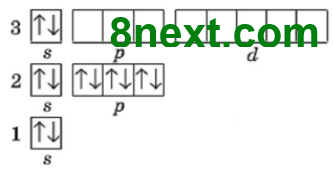
За числом орбіталей, що складають енергетичні рівні, визначте, скільки електронів може максимально міститися на другому і третьому енергетичних рівнях.
2-й енергетичний рівень містить одну s-орбіталь і три p-орбіталі, разом 4 орбіталі, а на кожній орбіталі максимально може міститися два електрони, тому всіх 4•2=8 електронів
3-й енергетичний рівень містить одну s-орбіталь, три p-орбіталі і п'ять d-орбіталей, разом 9 орбіталей, а на кожній орбіталі максимально може міститися два електрони, тому всіх 9•2=18 електронів
Зверніть увагу, що третій енергетичний рівень заповнюється у елементів побічних підгруп, починаючи з 4 періоду.
Вправа 3
Назвіть два хімічні елементи, в атомах яких повністю заповнені зовнішні енергетичні рівні.
Гелій He, Неон Ne, Аргон Ar, Криптон Kr, Ксенон Xe, тобто в в атомах інертних елементів.
Вправа 4
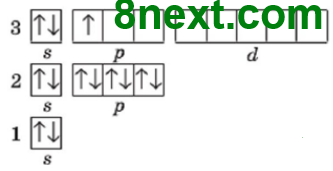
Скільки неспарених електронів в електронній оболонці атома Оксигену? Два

Атоми ще якого хімічного елемента другого періоду містять таке саме число неспарених електронів? Карбону
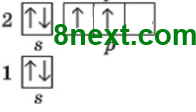
Вправа 5
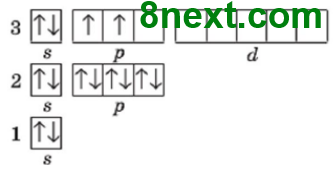
Зобразіть будову електронних оболонок атомів Нітрогену та Фосфору.
Нітроген 1s22s22p3, або [He]2s22p3

Фосфор 1s22s22p63s23p3, або [Ne]3s23p3
Що спільного в будові електронних оболонок цих атомів?
Число електронів на зовнішньому енергетичному рівні (п'ять, з них, одна електронна пара і три неспарених електрони).
Чим вони відрізняються?
Числом енергетичних рівнів (два в атомі Нітрогену, три ― Фосфору).
Вправа 6
Атоми яких елементів мають наведену електронну конфігурацію зовнішнього електронного рівня:
a) 1s2
Гелій Не (1 ― номер періоду, s-елемент ― головна підгрупа, 2 група)
6) 2s2
Берилій Ве (2 ― номер періоду, s-елемент ― головна підгрупа, 2 група)
в) 2s22p4
Оксиген О (2 ― номер періоду, р-елемент ― головна підгрупа, 2+4=6 група)
г) 3s23p2
Силіцій Si (3 ― номер періоду, р-елемент ― головна підгрупа, 2+2=4 група)
д) 4s2
Кальцій Са (4 ― номер періоду, s-елемент ― головна підгрупа, 2 група)
Пояснення. Перша цифра в запису електронної конфігурації вказує на номер періоду, в якому перебуває елемент, s- i p-елементи є елементами головних підгруп, а сума s- і р-електронів дорівнює номеру групи.
Вправа 7
Атом якого елемента другого періоду містить найбільше число:
а) електронів;
Неон Ne (10 електронів)
6) неспарених електронів;
Нітроген N (3 неспарених електрони)
в) електронних пар?
Неон Ne (5 електронних пар)