![]()
Контрольні запитання
Запитання 1
Чому перший період містить лише два хімічні елементи, а другий — вісім?
Структура Періодичної системи повністю зумовлена принципами будови електронної оболонки атомів.
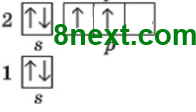
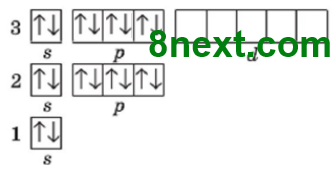
Перший енергетичний рівень містить один s-підрівень, а один s-підрівень містить 1 орбіталь. Одна орбіталь містить максимально два електрони, тому перший період містить лише два хімічні елементи: 1 Н – 2 Не.
Другий енергетичний рівень містить s- і р-підрівень, а s-підрівень містить 1 орбіталь і р-підрівень ― 3 орбіталі, разом 4 орбіталі. Кожна орбіталь містить максимально два електрони, отже, загальне число електронів буде вісім, тому другий період містить вісім хімічних елементів: 3 Li – 10 N.
Чим зумовлена місткість періодів Періодичної системи? Місткістю відповідних енергетичних рівнів і підрівнів електронної оболонки атомів, адже число енергетичних рівнів, що заповнюються в атомі певного елемента, визначають за номером періоду Періодичної системи, у якому розташований цей хімічний елемент.
Запитання 2
Число енергетичних рівнів, що заповнюються електронами визначають:
а) за номером періоду
б) за номером групи
в) за порядковим номером елемента
Запитання 3
Число електронів на зовнішньому енергетичному рівні визначають:
а) за номером періоду
б) за номером групи
в) за порядковим номером
Запитання 4
Як визначити максимальне число електронів, що може міститися на енергетичному рівні? За формулою 2n2, де n – номер енергетичного рівня.
Завдання 5
Скільки елементів належить до четвертого й шостого періодів?
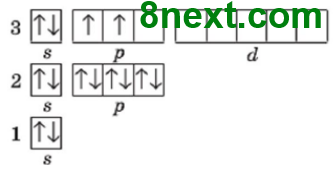
Четвертий енергетичний рівень заповненими може містити s-, р- та d-підрівень, а s-підрівень містить 1 орбіталь, р-підрівень ― 3 орбіталі, а d-підрівень ― 5 орбіталей, разом 9 орбіталей. Кожна орбіталь містить максимально два електрони, отже, загальне число електронів буде вісімнадцять, тому четвертий період містить вісімнадцять хімічних елементів: 19 К – 36 Kr.
Шостий енергетичний рівень містить s-, р-, d- та f-підрівень, а s-підрівень містить 1 орбіталь, р-підрівень ― 3 орбіталі, d-підрівень ― 5 орбіталей, а f-підрівень ― 7 орбіталей, разом 16 орбіталей. Кожна орбіталь містить максимально два електрони, отже, загальне число електронів буде тридцять два, тому четвертий період містить тридцять два хімічних елементів: 55 Cs – 86 Rn.
Скільки електронів може містити четвертий енергетичний рівень?
Обчислюємо за формулою: 2n2, де n ― номер енергетичного рівня, тому 2•42=32 електрони.
(Зверніть увагу, що на четвертому рівні додається ще сім f-орбіталей, і загалом четвертий рівень складається із 16 орбіталей. Отже, загальне число орбіталей на рівні n відповідає кількості n2).
Запитання 6
Поясніть, чому Натрій і Калій є електронними аналогами? Натрій і Калій мають однакову кількість електронів на зовнішньому енергетичному рівні і відрізняються лише кількістю енергетичних рівнів, тобто, подібною є будова зовнішнього електронного рівня цих елементів.
Запитання 7
За яким принципом елементи поділяють на s-, р-, d- та f-елементи? Який із підрівнів: s-, р-, d- чи f- заповнюється останнім, відповідно хімічний елемент буде відноситися до s-, р-, d- та f-елемента.
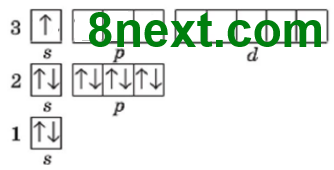
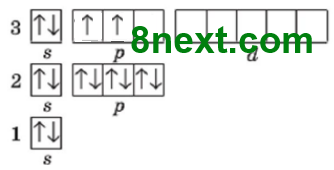
Наведіть приклади d-елементів п'ятого періоду і f-елементів сьомого періоду. d-елементами п'ятого періоду є всі елементи побічних груп цього періоду, а f-елементами сьомого періоду ― елементи родини актиноїди.
Приклад d-елементів п'ятого періоду: Цирконій Zr, Молібден Мо.
Приклад f-елементів сьомого періоду: Нептуній Np, Уран U.
Запитання 8
Скільки s- і р-елементів може містити один період? Два s-елементи і шість р-елементів.
Відповідь поясніть. Те, що мова йде про s- і р-елементи, означає, що останніми заповнюються s- або р- підрівні, з них, s-підрівень містить одну орбіталь, а р-підрівень містить три орбіталі. Кожна орбіталь містить максимально два електрони, тому s-підрівень містить два електрони, тобто, два s-елементи, а р-підрівень ― шість електронів, тобто шість p-елементів.
Запитання 9
Як називають родини хімічних елементів, в атомах яких останнім заповнюється f-підрівень? Дві родини елементів ― лантаноїди і актиноїди.
Завдання для засвоєння матеріалу
Вправа 1
Який рівень складається тільки:
а) з s-підрівня
Перший рівень
б) s- та р-підрівнів
Другий рівень
в) s-, р- та d-підрівнів
Третій рівень
Як ви це визначили? За правилом: число енергетичних підрівнів на енергетичному рівні дорівнює номеру цього рівня.
Вправа 2
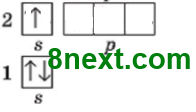
Які хімічні елементи є електронними аналогами Нітрогену? Усі елементи V групи головної підгрупи, тобто Фосфор Р, Арсен As, Стибій Sb, Бісмут Bi, адже мають однакову кількість електронів на зовнішньому енергетичному рівні і відрізняються лише кількістю енергетичних рівнів, тобто подібною є будова зовнішнього електронного рівня цих елементів.
Зобразіть електронну конфігурацію атома одного з них.
Фосфор 1s22s22p63s23p3 або [Ne]3s23p3
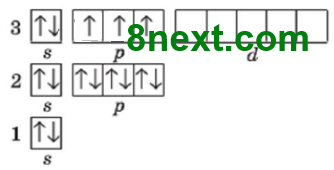
Вправа 3
У чому полягає принципова відмінність у будові електронної оболонки атомів головних і побічних підгруп? У атомів елементів головних підгруп число електронів на зовнішньому енергетичному співпадає з номером групи, в якій розміщується елемент, а в атомів побічних підгруп ― як правило, 2 електрони.
Вправа 4
Який енергетичний підрівень заповнюється останнім:
а) у s-елементів четвертого періоду
4s-підрівень
6) р-елементів п'ятого періоду
5р-підрівень
в) s-елементів третього періоду
3s-підрівень
г) р-елементів другого періоду
2р-підрівень
Вправа 5
Назвіть два елементи, в атомах яких число пар електронів дорівнює числу неспарених електронів.
У Карбона і Літію в атомах число пар електронів дорівнює числу неспарених електронів.
| Карбон | Літій |
|
1s22s22p2
2 пари електронів 2 неспарені електрони |
1s22s1
1 пара електронів 1 неспарений електрон |
Вправа 6
Запишіть електронні формули атомів елементів з порядковими номерами 11 і 14.
1s22s22p63s1
1s22s22p63s23p2
Вправа 7
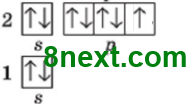
Назвіть металічний та неметалічний елементи другого періоду, які на зовнішньому рівні мають один неспарений електрон. Літій і Флуор.
|
металічний Літій 1s22s1
|
неметалічний Флуор 1s22s22р5
|
Вправа 8
Який енергетичний рівень заповнюється електронами в атомах елементів:
№3 ― другий енергетичний рівень, бо є елементом 2 періоду
№9 ― другий енергетичний рівень, бо є елементом 2 періоду
№16 ― третій енергетичний рівень, бо є елементом 3 періоду
Пояснення: номер періоду, в якому розміщений елемент, відповідає номеру енергетичного рівня.
Вправа 9
Складіть графічну електронну формулу елемента з порядковим номером 15. Складіть формули його вищого оксиду та гідратів цього оксиду. Зазначте хімічний характер оксиду та його гідратів.
Графічна електронна будова Фосфору:

Формула вищого оксиду Р2О5, гідрату оксиду Н3РО4.
Хімічний характер оксиду та його гідратів ― кислотний.
Вправа 10
Який елемент другого періоду є електронним аналогом елемента з порядковим номером №12? Електронними аналогами є елементи, розміщені в одній групі і одній підгрупі. Елемент №12 ― це Магній, розміщений в головній підгрупі ІІ групи, тому його електронним аналогом є елемент ІІ групи головної підгрупи, наприклад, №20 Кальцій чи №4 Берилій.
Вправа 11
Складіть графічну електронну формулу атомів Силіцію, Бору та Аргону.
|
Силіцію
|
|
Бору
|
|
Аргону
|
Вправа 12
Атому якого з елементів відповідає кожна з наведених електронних формул:
a) 1s22s22p3
Нітрогену N
6) 1s22s22p63s23p6
Аргону Ar
в) 1s22s22p63s23p64s2
Кальцію Ca
Пояснення. Сума електронів у записі електронної формули атома елемента чисельно дорівнює його порядковому номеру, тому знаходимо суму електронів і визначаємо відповідний елемент.
а) всього 7 електронів, бо 1s22s22p3: 2+2+3=7, №7 - це Нітроген;
б) всього 18 електронів, бо 1s22s22p63s23p6: 2+2+6+2+6=18, №18 - це Аргон;
в) всього 20 електронів, бо 1s22s22p63s23p64s2: 2+2+6+2+6+2=20, №20 - це Кальцій.
Вправа 13
Атоми яких елементів мають таку будову зовнішнього електронного шару:
a) 3s2Зр1
Алюміній
Електронна оболонка атома має 3 енергетичні рівні, тому елемент розміщений у 3 періоді. Атом має два s- і один р-електрони, разом 3 електрони, тому є елементом ІІІ групи головної підгрупи.
6) 3s23p3
Фосфор
Електронна оболонка атома має 3 енергетичні рівні, тому елемент розміщений у 3 періоді. Атом має два s- і три р-електрони, разом 5 електронів, тому є елементом V групи головної підгрупи.
в) 3s1
Натрій
Електронна оболонка атома має 3 енергетичні рівні, тому елемент розміщений у 3 періоді. Атом має один s-електрон, тому є елементом І групи головної підгрупи.
г) 4s2
Кальцій
Електронна оболонка атома має 4 енергетичні рівні, тому елемент розміщений у 4 періоді. Атом має два s-електрони, тому є елементом ІІ групи головної підгрупи.
Вправа 14
Що є спільним у будові атомів Берилію, Магнію та Кальцію? Однакове число електронів на зовнішньому енергетичному рівні (два електрони), адже ці елементи є електронними аналогами і розміщені в головній підгрупі ІІ групи.
Вправа 15
Скільки електронів міститься на зовнішньому електронному рівні в атомів:
a) Арсену
П'ять електронів, адже є елементом V групи
б) Cтануму
Чотири електрони, адже є елементом IV групи
в) Барію
Два електрони, адже є елементом ІІ групи
Пояснення: на кількість електронів на зовнішньому рівні атома для елементів головних підгруп вказує номер групи, в якій він розміщений.
---------------------------- ПРОГРАМА 2016 року ---------------------------------
Запитання 7
За яким принципом елементи поділяють на s-, р-, d- та f-елементи? Який із підрівнів: s-, р-, d- чи f- заповнюється останнім, відповідно хімічний елемент буде відноситися до s-, р-, d- та f-елемента.
Наведіть приклади d-елементів і f-елементів сьомого періоду. d-елементами є всі елементи побічних груп цього періоду, а f-елементами ― елементи родини актиноїди. Приклад d-елементів: Актиній Ас, Розерфордій Rf. Приклад f-елементів: Нептуній Np, Уран U.
Вправа 6
Запишіть електронні конфігурації атомів елементів з порядковими номерами 11 і 14.
|
11Na [Ne]3s1 або 1s22s22p63s1
|
|
14Si [Ne]3s23p2 або 1s22s22p63s23p2
|
Вправа 9
Запишіть схему електронної будови атома елемента з порядковим номером 15. Які властивості виявляє цей елемент і чому? Складіть формули його вищих оксиду і гідрату оксиду.
Електронна будова Фосфору: 1s22s22р33s23p3 або [Ne]3s23p3

Неметалічний елемент, бо є р-елементом.
Формула вищого оксиду Р2О5, гідрату оксиду Н3РО4