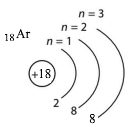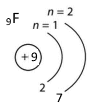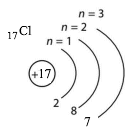Інші завдання дивись тут...
© 8next.com (відповіді, перероблене і доповнене)
Вправа 337
Чим зумовлені металічні та неметалічні властивості хімічних елементів?
Металічні та неметалічні властивості хімічних елементів зумовлені електронною будовою атомів, а саме електронами, що перебувають на зовнішніх енергетичних рівнях. Для металічних елементів характерне невелике число електронів (зазвичай 1–3), а неметалічних ― чотири і більше електронів.
Вправа 338
Чому атоми приймають або віддають електрони в хімічних реакціях?
Атоми приймають або віддають електрони в хімічних реакціях, щоб їхня електронна оболонка стала такою, як в атома найближчого інертного елемента.
Вправа 339
Як змінюється сила притягання електронів зовнішнього енергетичного рівня до ядра в періоді й у групі?
У періоді зі збільшенням порядкового номера хімічного елемента (зліва направо) не змінюється кількість енергетичних рівнів, а заряд ядра поступово зростає, тому електрони притягуються до ядра сильніше.
У групах зі збільшенням порядкового номера хімічного елемента (зверху донизу) збільшується число енергетичних рівнів з електронами, а чим далі від ядра розташовані зовнішні електрони, тим слабше вони притягуються до нього.
Вправа 340
Як змінюються металічні й неметалічні властивості елементів у групах і періодах Періодичної таблиці зі збільшенням порядкового номера? Чим можна пояснити такі зміни?
У групі із збільшенням порядкового номера (зверху донизу) металічні властивості елементів і утворених ними простих речовин посилюються, а неметалічні — послаблюються. Такі зміни можна пояснити тим, що в елементів однієї групи зі збільшенням порядкового номера в електронній оболонці атома збільшується число енергетичних рівнів, зовнішні електрони легше втрачати, тому металічні властивості посилюються, а неметалічні — послаблюються.
У періоді із збільшенням порядкового номера (зліва направо) металічні властивості елементів і утворених ними простих речовин послаблюються, а неметалічні — посилюються. Такі зміни можна пояснити тим, що в елементів одного періоду зі збільшенням порядкового номера в електронній оболонці атома збільшується число зовнішніх електронів, які важче втрачати, тому металічні властивості послаблюються, а неметалічні — посилюються.
Вправа 341
Скільки протонів і електронів містить:
а) атом Алюмінію;
Хімічний елемент Алюміній має порядковий номер 13, який чисельно дорівнює числу протонів і електронів в ядрі атома, тому атом Алюмінію має 13 протонів і 13 електронів.
б) йон Аl3+?
Оскільки йон Алюмінію утворюється з атома Алюмінію, що втратив 3 електрони, тому йон має 13 протонів і 10 (13–3=10) електронів.
Вправа 342
Атом якого хімічного елемента містить стільки ж електронів, скільки їх у йоні Li+?
Порядковий номер хімічного елемента Літій дорівнює 3, тому атом Літію має 3 протони і 3 електрони. Йон Літію утворюється з атома втратою одного електрона, тому йон Літію містить 2 (3–1=2) електрони. Стільки електронів має атом хімічного елемента з порядковим номером 2 ― це Гелій Не.
Вправа 343
Порівняйте електронну будову йонів S2– , Сl–, K+, Ca2+ із будовою атома Аргону.
Електронні будови атома Аргону і йонів Сульфуру, Хлору, Кальцію однакові (3 енергетичні рівні, 18 електронів).
Вправа 344
Скільки електронів бракує до завершення зовнішнього енергетичного рівня атомам:
а) Оксигену;
Елемент Оксиген міститься в 16 групі, тому в атома Оксигену на зовнішньому енергетичному рівні 6 електронів. Отже, до завершення йому бракує 2 (8–6=2) електрони.
б) Хлору;
Елемент Хлор міститься в 17 групі, тому в атома Хлору на зовнішньому енергетичному рівні 7 електронів. Отже, до завершення йому бракує 1 (8–7=1) електрон.
в) Силіцию?
Елемент Силіцій міститься в 14 групі, тому в атома Силіцію на зовнішньому енергетичному рівні 4 електрони. Отже, до завершення йому бракує 4 (8–4=4) електрони.
Примітка. Завершеним вважається зовнішній енергетичний рівень, що містить 8 електронів.
Вправа 345
Йон певного хімічного елемента Е2+ має таку саму електронну будову, як і атом Неону. Визначте цей елемент.
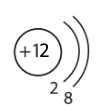
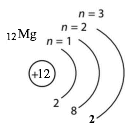
Хімічний елемент Неон має порядковий номер 10, тому в електронній оболонці атома Неону міститься 10 електронів. Йон Е2+ має 10 електронів і утворюється в результаті втрати атомом хімічного елемента Е двох електронів, тому атом хімічного елемента Е містить 12 (10+2=12) електронів. Отже, цим елементом є Магній.
Вправа 346
За Періодичною таблицею визначте число електронів, яке максимально може віддавати та приєднувати в хімічних реакціях атом Фосфору.
Хімічний елемент Фосфор розміщується в 15 групі Періодичної таблиці, тому на зовнішньому енергетичному рівні атом містить 5 електронів, з яких 3 неспарені, тому в хімічних реакція атом Фосфору може максимально віддати 5 електронів або приєднати 3 електрони.
Вправа 347
Чому істотно відрізняються за властивостями хімічні елементи 1–ї та 17–ї груп? Поясніть відповідь із погляду будови їхніх електронних оболонок.
Хімічні елементи 1–ї групи мають на зовнішньому енергетичному рівні лише 1 електрон, який з легкістю віддають, що зумовлює їхні типові металічні властивості. Хімічні елементи 17–ї групи мають на зовнішньому енергетичному рівні 7 електронів, тому вони з легкістю приєднують один електрон, що зумовлює їхні типові неметалічні властивості. Типові металічні і неметалічні елементи істотно відрізняються своїми властивостями.
Вправа 348
Чи існують відмінності між електронною оболонкою йона Магнію та оболонкою: а) атома Магнію, б) атома Неону, в) йона Ca2+, г) аніона O–2? Яка відмінність існує та в чому вона полягає?
а) йона Магнію і атома Магнію;
| Електронна будова |
| йон Магнію |
атом Магнію |
 |
 |
Так, існують відмінності.
Відмінність електронної оболонки йона Магнію і атома Магнію полягає в різній кількості електронів (10 і 12 відповідно) і енергетичних рівнів (2 і 3 відповідно).
Це пояснюється тим, що атом Магнію втрачає два електрони і перетворюється на йон Магнію.
б) йона Магнію та атома Неону;
| Електронна будова |
| йон Магнію |
атом Неон |
 |
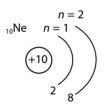 |
Ні, не існують відмінності.
Це пояснюється тим, що йон Магнію має електронну будову, як в атомі інертного елемента Неону.
в) йона Mg2+ і йона К+?
| Електронна будова |
| йон Mg2+ |
йон Са2+ |
 |
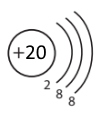 |
Так, існують відмінності.
Відмінність електронної оболонки йона Магнію і йона Кальцію полягає в різній кількості електронів (12 і 20 відповідно) і енергетичних рівнів (2 і 3 відповідно).
Це пояснюється тим, що йон Магнію має електронну будову, як в атомах інертного елемента Аргону.
г) йона Mg2+ і аніона O2–?
| Електронна будова |
| йон Mg2+ |
йон O2– |
 |
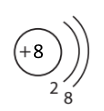 |
Ні, не існують відмінності.
Це пояснюється тим, що йон Магнію і йон Оксигену мають електронну будову, як в атомах інертного елемента Неону.
Вправа 349
Чому хімічні елементи Флуор і Хлор мають подібні властивості? У чому полягають відмінності та чим вони зумовлені?
| Електронна будова |
| атом Флуор |
атом Хлор |
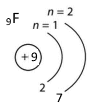 |
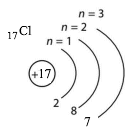 |
Хімічні елементи Флуор і Хлор мають подібні властивості, бо атоми елементів мають однакову будову зовнішнього енергетичного рівня (по 7 електронів кожен). Відмінності полягають в тому, що Флуор є більш хімічно активнішим неметалічним елементом у порівнянні з Хлором. Ці відмінності зумовлені меншою кількістю енергетичних рівнів в електронній оболонці атома Флуору в порівнянні з атомом Хлору.
_______________Видання 2021 і 2016 років_________________________
§14 2021 / §15 2016 БУДОВА ЕЛЕКТРОННИХ ОБОЛОНОК АТОМІВ І ВЛАСТИВОСТІ ХІМІЧНИХ ЕЛЕМЕНТІВ
Контрольні запитання
Запитання 1
Чим зумовлені металічні та неметалічні властивості елементів? Будовою електронних оболонок атомів. Металічні властивості виявляють переважно елементи, в атомів яких на зовнішніх рівнях міститься не більше чотирьох електронів, а неметалічні ― чотири і більше.
Запитання 2
Як визначити число валентних електронів в електронних оболонках атомів хімічних елементів головних підгруп? За номером групи, в якій розміщений елемент, бо валентні електрони ― це електрони зовнішнього енергетичного рівня.
Запитання 3
Чому атоми приймають або віддають електрони в хімічних реакціях?
Бо прагнуть мати стійку електронну оболонку, яка є в атомі найближчого інертного елемента.
Запитання 4
Чому інертні елементи не вступають у хімічні реакції? Мають надзвичайно стійку електронну оболонку атома (енергетичний рівень завершений, всі електрони спарені), що зумовлює їх хімічну інертність.
Запитання 5
Які частинки називають йонами? Заряджені частинки, які утворюються внаслідок приєднання або віддавання атомом електронів.
Запитання 6
Як змінюється сила притягання валентних електронів до ядра в періоді і в підгрупі?
У періоді за зростанням заряду ядер і зменшення радіуса, посилюється сила притягання ядром електронів зовнішнього енергетичного рівня, властивість віддавати електрони послаблюється, а приєднувати посилюється.
У групі головної підгрупи зростає радіус атома, а чим далі від ядра розташовані валентні електрони, тим менше вони притягуються до ядра, послаблюється зв'язок з зовнішнім енергетичним рівнем, здатність віддавати електрони посилюється, а здатність приєднувати електрони послаблюється.
Запитання 7
Як змінюються металічні й неметалічні властивості елементів у групах і періодах Періодичної системи зі збільшенням порядкового номера?
У групах зі збільшенням порядкового номера елементів металічні властивості посилюються, а неметалічні ― послаблюються.
У періодах зі збільшенням порядкового номера елементів металічні властивості послаблюються, а неметалічні ― посилюються.
Чим пояснюються такі зміни? Будовою електронних оболонок атомів.
Запитання 8
Чим зумовлений радіус атомів? Числом енергетичних рівнів атома.
Як він змінюється в періодах і групах? У періодах радіус атома зменшується, а в групах – зростає.
Завдання для засвоєння матеріалу.
Вправа 1
Випишіть із наведеного переліку окремо символи:
Na, Na+, О, O2, О2–, Fe, SO42–, Mg2+, HNO3, NO3–, NH4–, NO2.
а) атомів
Na, O, Fe
6) катіонів
Na+, Mg2+, NH4+
в) аніонів
O2–, SO42–, NO3–
г) молекул
O2, NO2, HNO3
Пояснення: атоми ― електронейтральні частинки. Молекули складаються з атомів. Йони ― це заряджені частинки, утворені з атома приєднанням чи втратою електронів. Катіони ― йони з позитивним зарядом, а аніони ― йони з негативним зарядом.
Вправа 2
Запишіть електронну конфігурацію:
а) атома Хлору і йона Сl–;
1s22s22p63s23p5 і 1s22s22p63s23p6
Атом Хлору, приєднуючи один електрон перетворюється на йон Хлору
б) атома Магнію і йона Мg2+.
1s22s22p63s2 і 1s22s22p6
Атом Магнію, втрачаючи два електрони перетворюється на йон Магнію.
Вправа 3
Скільки протонів і електронів містить:
а) атом Алюмінію
Протонів 13 і електронів 13
Пояснення: на число протонів в ядрі атома вказує порядковий номер Алюмінію (№13), а число протонів і електронів однакове (13).
6) йон Аl3+ ?
Протонів 13 і електронів 10
Пояснення: на число протонів в ядрі атома вказує порядковий номер Алюмінію (№13), а йон утворюється внаслідок втрати атомом трьох електронів, тому число електронів у йоні рівне: 13–3=10
Вправа 4
Атом якого елемента містить стільки ж електронів, скільки їх у йоні Na+?
Атом Неону Ne
Пояснення: йон Na+ містить 11 протонів (порядковий №11) і 10 електронів (11–1=10), бо утворюється з атома внаслідок втрати ним одного електрона. Стільки ж електронів містить атом Неону (порядковий номер №10).
Вправа 5
Порівняєте електронну будову йонів S2–, Сl–, К+, Са2+ з будовою атома Аргону. Однакова будова.
| S2– 1s22s22p63s23p6.
Сl– 1s22s22p63s23p6.
К+ 1s22s22p63s23p6.
Са2+ 1s22s22p63s23p6.
Ar 1s22s22p63s23p6 |
Вправа 6
Скільки електронів бракує до завершення зовнішнього енергетичного рівня атомам:
а) Оксигену
Два електрони
б) Хлору
Один електрон
в) Фосфору
П'ять електронів
Пояснення: завершений енергетичний рівень містить 8 електронів. У атома Оксигену на зовнішньому енергетичному рівні 6 електронів (збігається з номером групи для елементів головних підгруп), йому до завершення бракує 2 (8–6=2) електрони, для Хлору ― 1 (8–7=1) електрон, для Фосфору ― 3 (8–5=3) електрони.
Вправа 7
Йон певного елемента Е2+ має таку саму електронну будову, що й атом Аргону. Визначте цей елемент. Кальцій Са.
Пояснення: атом Аргону містить 18 електронів (число електронів = протонному числу = порядковому номеру елемента). Йон Е2+ утворюється внаслідок втрати атомом двох електронів. За умовою йон має таку саму будову, що й атом Аргону, тому атом елемента Е містить 18+2=20 електронів. Цим елементом є Кальцій Са.
Вправа 8
За Періодичною системою визначте число електронів, яке максимально може віддавати та приєднувати в хімічних реакціях атом Фосфору. Максимально може віддавати п'ять, а приєднувати три електрони.
Пояснення: атом Фосфору на останньому енергетичному рівні містить п'ять електронів (для елементів головних підгруп вказує номер групи), тому може максимально віддавати п'ять електронів або приєднувати три, щоб їхня електронна оболонка стала такою, як в атомів найближчого інертного елемента.
Вправа 9
Чому істотно відрізняються за властивостями елементи головних підгруп І і VII груп? Поясніть відповідь з погляду будови їхніх електронних оболонок. Суттєво відрізняють числом електронів на зовнішньому енергетичному рівні. Лужні елементи містять один електрон, а галогени ― сім. Прості речовини лужних елементів є типовими металами, а галогенів ― неметалами.
Вправа 10
У чому полягає відмінність електронної оболонки йона Натрію від електронних оболонок:
а) атома Натрію
Йон Натрію містить на один електрон менше, ніж атом Натрію.
б) атома Неону
Різний заряд ядра атома (11 і 10).
в) йона К+.
Різний заряд ядра атома (11 і 19), різне число енергетичних рівнів (2 і 3).
Вправа 11
Чому хімічні елементи Флуор і Хлор мають подібні властивості? Знаходяться в одній (VII) групі головної підгрупи, іншими словами є електронними аналогами.
Інші завдання дивись тут...