![]()
План характеристики хімічного елемента.
1. Розміщення в Періодичній системі.
Порядковий номер елемента, у якому періоді, групі, підгрупі перебуває елемент.
2. Будова атома
Заряд ядра та його склад (кількість протонів, нейтронів). Кількість електронів, кількість енергетичних рівнів і розподіл в них електронів. Графічне зображення будови зовнішнього енергетичнго рівня, формула електронної конфігурації.
3.Характеристика хімічного елемента.
s-,p-,d-,f-елемент, металічний чи неметалічний елемент.
4. Відносна атомна маса.
5. Вища валентність та формула вищого оксиду.
6. Гідрат вищого оксиду та його характер;
7. Формула леткої сполуки з Гідрогеном.
8. Порівняння металічних і неметалічних властивостей елемента із властивостями його сусідніх елементів.
Контрольні запитання
Запитання 1
Від чого залежить радіус атома: а) від числа енергетичних рівнів
Запитання 2
Спільне в будові зовнішньої електронної оболонки металічних елементів: на зовнішній електронній оболонці міститься не більше 4 електронів.
Спільне в будові зовнішньої електронної оболонки неметалічних елементів: на зовнішній електронній оболонці міститься 4 і більше електронів.
Завдання для засвоєння матеріалу
Вправа 1
Хімічний елемент четвертого періоду виявляє найсильніші:
а) металічні властивості
Калій (порядковий номер №19)
6) неметалічні властивості?
Бром (порядковий номер №35)
Пояснення: в періоді із зростанням порядкового номера елемента металічні властивості послаблюються, а неметалічні посилюються. Галогени хімічно інертні.
Вправа 2
Елемент головної підгрупи IV групи, у якого найсильніше виражені неметалічні властивості: Карбон (№6)
Пояснення: в VI групі порядковий номер елемента Карбону є найменший, а в групі із спадання порядкового номера елемента неметалічні властивості посилюються.
Вправа 3
а) Al, Na, Mg;
У періоді із спаданням порядкового номера елемента металічні властивості посилюються, тому елементи треба розташувати в такій послідовності:
Al (№13), Mg (№12), Na (№11).
б) Са, Ва, Sr.
У групі головної підгрупи із зростанням порядкового номера елемента металічні властивості посилюються, тому елементи треба розташувати в такій послідовності: Са (№20), Sr (№38), Ва (№56).
Вправа 4
Характеристика хімічних елементів Берилію, Оксигену за планом, наведеним у цьому параграфі.
| Берилій |
Оксиген |
|
Порядковий номер 4, 2-ий період, |
Порядковий номер 8, 2-ий період,VI група, головна підгрупа |
|
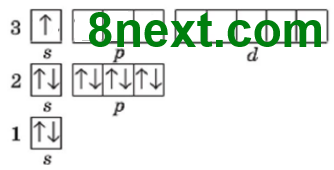
Заряд ядра +4, містить 4 протони, 5 нейтронів (9-4=5), 4 електрони. Електронна оболонка складається з 2 енергетичних рівнів. На зовнішньому рівні міститься одна електронна пара. Будова зовніш- нього електронного рівня:
Електронна формула: 1s22s2 |
Заряд ядра +8, містить 8 протонів, 8 нейтронів (16-8=8), 8 електронів. Електронна оболонка складається з 2 енергетичних рівнів. На зовнішньому рівні міститься дві електронні пари і 2 неспарені електрони. Будова зовнішнього електронного рівня:
|
|
s-елемент, металічний, для набуття електронної конфі- гурації найближчого інертного елемента втрачає 2 електрони |
р-елемент, неталічний, до завершення електронного рівня приймає 2 електрони
|
| Ar(Be)=9 | Ar(O)=16 |
|
Вища валентність ІІ, формула вищого оксиду ВеО |
Вища валентність: ІІ ― |
|
Ве(ОН)2, основа |
― |
|
Леткої сполуки з Гідрогеном не утворює |
Н2О
|
|
Металічні властивості виражені сильніше, ніж у Бору, але слабше ніж у Літію і Магнію |
Неметалічні властивості виражені сильніше, ніж у Нітрогену і Суль- фуру, але слабше, ніж у Флуору |
Характеристика хімічних елементів Натрію та Фосфору за планом, наведеним у цьому параграфі.
| Натрій |
Фосфор |
|
Порядковий номер 11, 3-ий період, |
Порядковий номер 15, 3-ий період, |
|
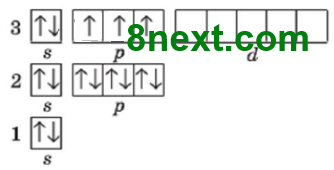
Заряд ядра +11, містить 11 протонів, 12 нейтронів (23-11=12), 11 електронів. Електронна оболонка складається з трьох енергетичних рівнів. На зовнішньому рівні міститься один неспарений електрон. Будова зовнішнього електронного рівня: Електронна формула: 1s22s22р63s1 |
Заряд ядра +15, містить 15 протонів, 16 нейтронів (31-15=16), 15 електронів. Електронна оболонка складається з трьох енергетичних рівнів. На зовнішньому рівні міститься одна електронна пара і три неспарені електрони. Будова зовнішнього електронного рівня:
Електронна формула: 1s22s22р63s23p3 |
|
s-елемент, металічний, для набуття електронної конфігурації найближчого інертного елемента втрачає 1 електрон |
р-елемент, неталічний, до завершення електронного рівня приймає 3 електрони
|
| Ar(Na)=23 | Ar(P)=31 |
|
Вища валентність І, формула вищого оксиду Na2О |
Вища валентність V, формула вищого оксиду P2О5 |
|
Формула гідрату вищого оксиду NaОН, основа (луг) |
Формула гідрату вищого оксиду H3PO4, кислота |
|
леткої сполуки з Гідргеном не утворює |
РН3
|
|
Металічні властивості виражені сильніше, ніж у Магнію і Літію, але слабше ніж Калію
|
Неметалічні властивості виражені сильніше, ніж у Силіцію і Арсену, але слабше, ніж у Сульфуру і Нітрогену |
Вправа 5
Три елементи А, Б та В розташовані в одному періоді. В атомі елемента А число енергетичних рівнів у два рази менше, ніж число електронів на його зовнішньому рівні. Елемент Б — найпоширеніший елемент у природі, з елементом А він утворює сполуку АБ2. Елемент В утворює луг. Ці елементи утворюють речовину складу В2АБ3. Назвіть всі елементи і складіть формули речовин, про які йдеться.
Елемент А ― Карбон, Б ― Оксиген, В ― Літій (лужний елемент).
Сполука АБ2 ― СО2, В2АБ3 ― Li2СO3
Пояснення: це елементи другого періоду. Атом Карбону містить 2 енергетичні рівні, а число електронів на зовнішньому рівні 4, тому число енергетичних рівнів є у два рази менше. Оксиген є найпоширенішим елементом у природі, з Карбоном утворює сполуку СО2 ― вуглекислий газ. Літій є лужним елементом і з Карбоном і Оксигеном утворює речовину складу Li2CO3.
Вправа 6*
Гідроген іноді розташовують одночасно в першій і сьомій групах Періодичної системи, бо проста речовина має подібні властивості з галогенами.