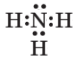© 8next.com (відповіді, перероблене і доповнене)
 |
 |
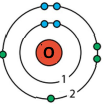 |
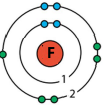 |
| Число неспарених електронів | |||
| 2 | 3 | 2 | 1 |
| Група в Періодичній таблиці | |||
| IV | V | VI | VII |
| Негативний заряд йона | |||
| 4– | 3– | 2– | 1– |
| водень | фтор | кисень | метан |
 |
 |
Вправа 363
| а) Хлору | б) Сульфуру | в) Фосфору |
|
3 електронні пари, 1 неспарений електрон |
2 електронні пари, 2 неспарені електрони |
1 електронна пара, 3 неспарені електрони |
|
Формули Льюїса |
||
|
|
|
|
Вправа 366
Скільки неспарених електронів містить:
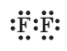
| Формули Льюїса для молекул | ||
|
хлороводню HCl |
сірководню H2S |
амоніаку NH3 |
|
|
|
|
|
Кількість електронних пар |
||
|
1 cпільна 3 неподілених |
2 cпільних 2 неподілених |
3 cпільних 1 неподілена |

Контрольні запитання
Запитання 1
Дайте визначення ковалентного зв'язку. Хімічний зв’язок, що виникає в результаті утворення спільних електронних пар, називають ковалентним.
Запитання 2
Спільна електронна пара — це:
а) пара електронів, що належить обом атомам, між якими утворений хімічний зв'язок;
6) пара електронів, що не утворює хімічного зв'язку;
в) два електрони, що перебувають на одному енергетичному підрівні.
Запитання З
Які електрони називають неспареними? Один електрон, що міститься на орбіталі, називають неспареним.
Запитання 4
Яку електронну пару називають неподіленою? Електронну пару, яка не бере участі в утворенні хімічного зв’язку, називають неподіленою.
Запитання 5
Який зв'язок називають:
а) одинарним
Зв’язок, що виникає завдяки утворенню однієї спільної електронної пари, є одинарним або ординарним.
6) подвійним
Зв’язок, що виникає завдяки утворенню двох спільних електронних пар, є подвійним.
в) потрійним
Зв’язок, що виникає завдяки утворенню трьох спільних електронних пар, є потрійним.
Наведіть приклади молекул з такими зв'язками.
а) Н2, F2, Br2, I2
б) О2
в) N2
При взаємодії двох атомів, кожний із яких має кілька неспарених електронів, утворюється відразу кілька спільних електронних пар.
Завдання для засвоєння матеріалу
Вправа 1
Скільки електронних пар і неспарених електронів містять на зовнішньому енергетичному рівні атоми:
а) Хлору;
Електронних пар: 3
Неспарених електронів: 1
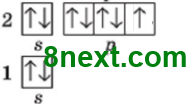
б) Сульфуру;
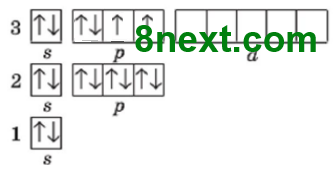
Електронних пар: 2
Неспарених електронів: 2
в) Фосфору?
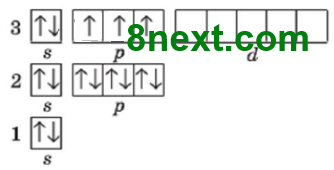
Електронних пар: 1
Неспарених електронів: 3
Складіть їхні формули Льюїса.
|
а) |
б) |
в) |
|
|
|
|
Вправа 2
Скільки неспарених електронів містить:
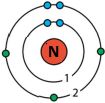
а) атом Флуору; Один неспарений електрон (…2s22p5).
б) молекула фтору? Не містить неспарених електронів, бо молекула утворюється з двох атомів за допомогою ковалентного зв’язку.
Вправа 3
Чому не можуть існувати двохатомні молекули інертних елементів? Під час утворення хімічного зв’язку атоми прагнуть того, щоб на їхньому зовнішньому енергетичному рівні було два або вісім (октет) електронів, як мають атоми інертних елементів. Отже, інертні елементи вже мають стійку електронну оболонку (завершений зовнішній енергетичний рівень, всі електрони спарені), тому їм не потрібні "чужі" електрони, вони є хімічно інертні (хімічні зв’язки не утворюють).
Вправа 4
Завдяки електронам якого шару здійснюється зв'язок між атомами:
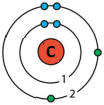
а) у молекулі водню; Першого рівня (поняття "шар" і "енергетичний рівень" ідентичні).
6) молекулі хлору? Третього рівня.
Зв'язок між атомами здійснюється завдяки електронам зовнішнього (останнього) енергетичного рівня.
Вправа 5
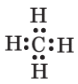
Складіть формули Льюїса для молекул хлороводню НСl, сірководню H2S, амоніаку NH3, метану СН4. Скільки спільних і неподілених електронних пар містять атоми в кожному випадку?
|
хлороводню НСl |
сірководню H2S |
амоніаку NH3 |
метану СН4 |
|
|
|
|
|
|
1 спільна, 3 неподілених |
2 спільних, 2 неподілених |
3 спільних, 1 неподілена |
3 спільних, 0 неподілених |
Вправа 6
Складіть формулу Льюіса для молекули сірки S2. Скільки електронних пар беруть участь в утворенні ковалентного зв'язку між атомами Сульфуру? Дві електронні пари беруть участь в утворенні ковалентного зв'язку.
Чи виконується правило октету? Правило октету виконується, кожен атом має вісім електронів: чотири спільні для обох атомів (дві спільні пари), і в кожного атома по дві власні електронні пари.
Вправа 7
Дано три електронні формули (дивись в підручнику). Які з наведених формул речовин відповідають кожній з них: NH3, НСl, О2, F2, N2, H2, HBr, Cl2?
а) HCl, HBr
б) F2, Cl2
в) O2
Яким речовинам не відповідає жодна електронна формула? NH3, N2
Вправа 8*
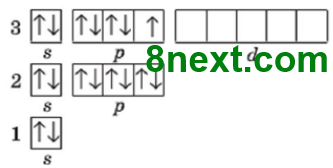
Складіть графічні електронні формули будови електронної оболонки атома Сульфуру в основному й збудженому станах, щоб на зовнішньому електронному рівні атома було чотири та шість неспарених електронів.
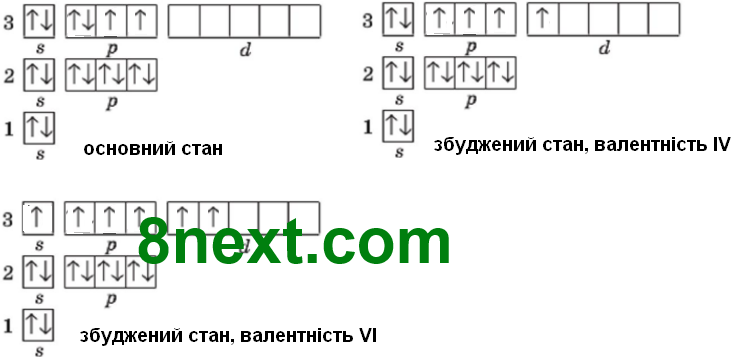
Складіть формули Льюіса для сульфур (ІV) оксиду та сульфур (VІ) оксиду.
|
|
 |
Вправа 9*
Складіть графічні електронні формули для електронних оболонок атомів Фосфору та Хлору в основному та різних можливих збуджених станах. Ґрунтуючись на них, поясніть можливі валентності, що можуть виявляти атоми Фосфору та Хлору в сполуках.
Фосфор:
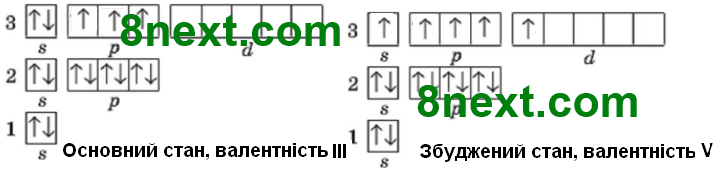
Хлор:
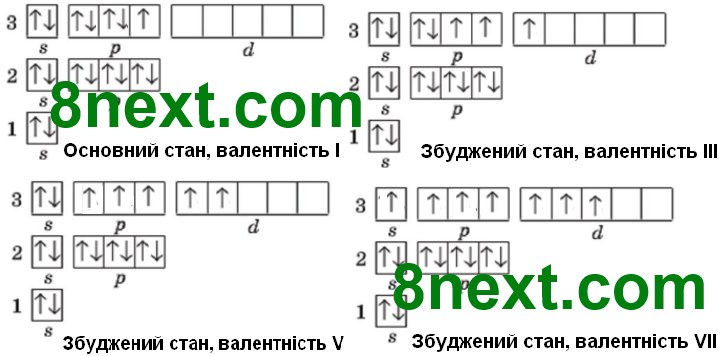
Вправа 10*
Утворення ковалентного зв’язку може відбуватися за обмінним (рекомбінаційним) механізмом, що описаний у цьому параграфі, та за донорно–акцепторним. Знайдіть у додатковій літературі відмінні та спільні риси між цими двома механізмами. Наведіть приклади частинок, у разі утворення яких має місце донорно–акцепторний механізм утворення ковалентного зв’язку.
У обох механізмах утворення ковалентних зв'язків відбувається за рахунок спільних електронних пар. Відмінність полягає в тому, що за обмінним (рекомбінаційним) механізмом спільні електронні пари з’являються за рахунок об’єднання неспарених електронів обох атомів, а за донорно–акцепторним механізмом — зміщенням неподіленої електронної пари одного атома у вільну орбіталь іншого.
Наприклад, в молекулі амоніаку є три прості ковалентні зв'язки, а в йоні амонію — чотири, вони однакові, хоча механізм їх утворення різний.