Завдання 1
Формула для обчислення кількості електронів на енергетичному рівні N = 2n², де n — номер рівня.
Заряд ядра атома дорівнює заряду протона й чисельно співпадає з порядковим номером хімічного елемента в Періодичній таблиці.
Кількість енергетичних рівнів відповідає номеру періоду в Періодичній таблиці.
Завдання 2
Що таке енергетичний рівень? Це рівні електронної оболонки атома хімічного елемента.
Як визначити кількість електронів в атомі елемента? За порядковим номером хімічного елемента в Періодичній таблиці.
Як визначити кількість електронів на зовнішньому енергетичному рівні? За номером групи Періодичної таблиці, в якій розміщений хімічний елемент.
Завдання 3
Використовуючи Періодичну таблицю хімічних елементів, визначте кількість енергетичних рівнів, на яких розміщуються електрони в атомі:
Флуору, Хлору, Брому; Два, три, чотири енергетичні рівні відповідно.
Берилію, Нітроґену, Фосфору, Арсену. Два, два, три, чотири енергетичні рівні відповідно.
Завдання 4
Складіть схеми будови електронних оболонок атомів Сульфуру, Нітроґену, Маґнію.
| Сульфур | Нітроґену | Маґнію |
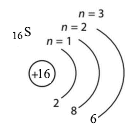 |
 |
 |
|
16S 2ē, 8ē, 6ē |
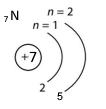
7N 2ē, 5ē |
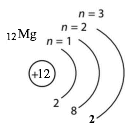
12Mg 2ē, 8ē, 2ē |
Завдання 5
Визначте положення хімічного елемента в Періодичній таблиці за його електронною формулою:
а) 2ē, 2ē;
Загальна кількість електронів 4 (2+2=4), отже, Z=4 — це Берилій (Ве).
б) 2ē, 8ē; Неон (Ne)
Загальна кількість електронів 10 (2+8=10), отже, Z=10 — це Неон (Nе).
в) 2ē, 8ē, 5ē. Фосфор (P)
Загальна кількість електронів 15 (2+8+5=15), отже, Z=15 — це Фосфор (Р).
Завдання 6
Порівняйте будову електронних оболонок атомів:
а) Карбону та Силіцію;
| Карбон | Силіцій |
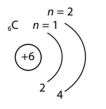 |
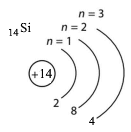 |
|
6C 2ē, 4ē |
14Si 2ē, 8ē, 4ē |
Подібні: однакова кількість електронів на зовнішньому енергетичному рівні (4).
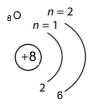
б) Карбону, Нітроґену, Оксиґену.
| Карбон | Нітроґен | Оксиґен |
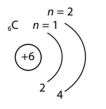 |
 |
 |
|
6C 2ē, 4ē |
7N 2ē, 5ē |
8O 2ē, 6ē |
Подібні: однакове число енергетичних рівнів в електронній оболонці атомів (2).
Завдання 7
Що спільного в електронній конфігурації атомів Бору та Алюмінію? Чим вони відрізняються?
| Бор | Алюміній |
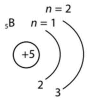 |
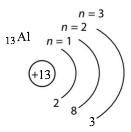 |
|
5B 2ē, 3ē |
13Al 2ē, 8ē, 3ē |
Подібні: однакова кількість електронів на зовнішньому енергетичному рівні (3).
Завдання 8
Елемент третього періоду на зовнішньому енергетичному рівні містить 6 електронів. Який порядковий номер цього елемента?
У 3–му періоді на внутрішніх рівнях міститься 10 (2+8=10) електронів, тому всього 16 (10+6=16) електронів, Z=16. Отже, порядковий номер 16.
Завдання 9
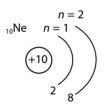
Запишіть назву та символи двох хімічних елементів, в атомах яких завершені енергетичні рівні.
| Неон Ne | Аргон Ar |
 |
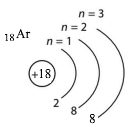 |
Завдання 10
Запишіть назву та символ хімічного елемента третього періоду, в атомі якого кількість електронів на зовнішньому енергетичному рівні у 2 рази менша від загальної кількості електронів на внутрішніх рівнях.
У 3–му періоді на внутрішніх рівнях міститься 10 (2+8=10) електронів, тоді у 2 рази менше, це 5 (10:2=5) електронів. Тому порядковий номер елемента 15 (10+5=15) — це Фосфор Р.
Завдання 11
Запишіть назву та символ хімічного елемента другого періоду, в атомі якого кількість електронів на зовнішньому енергетичному рівні у 2 рази більша від загальної кількості електронів на внутрішньому рівні.
У 2–му періоді на внутрішніх рівнях міститься 2 електрони, тоді в 2 рази більше, це 4 (2•2=4) електрони. Тому порядковий номер елемента 6 (2+4=6) — це Карбон С.
Завдання 12
Ізотоп Карбон–14 використовують для встановлення віку радіоактивним шляхом під час датування біоматеріалів у геології, археології та інших галузях науки. Визначте склад ядра та електронних оболонок атома Карбону–14. Складіть схему електронної будови 14С.
Z=6, p+=6, e–=6, А = 14, n0 = A – Z = 14 – 6 = 8.
Отже, заряд ядра атома Карбону (+6), ядро має 6 протонів і 8 нейтронів. У електронній оболонці атома міститься всього 6 електронів на двох енергетичних рівнях, з них, 2 електрони на внутрішньому рівні і 4 електрони на зовнішньому рівні.
| Карбон |
|
|
|
6C 2ē, 4ē, або С +6 )) 24 |
Завдання 13
Визначте склад ядра та електронних оболонок атома, якщо його протонне число дорівнює масовому числу ізотопа Оксиґену–16, а масове число — вдвічі більше за протонне.
Z = 16, A = 16 • 2 = 32, Ar=32, це Сульфур S.
Z=16, p+=16, e–=16, А = 32, n0 = A – Z = 32 – 16 = 16.
Отже, заряд ядра атома Сульфура (+16), ядро має 16 протонів і 16 нейтронів. У електронній оболонці атома міститься всього 16 електронів на трьох енергетичних рівнях (2,8,6), з них, 10 електронів на внутрішньому рівні і 6 електронів на зовнішньому рівні.
| Сульфур |
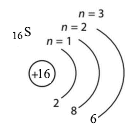 |
|
16S 2ē, 8ē, 6ē, або S +16 ))) 286 |