Перевірте себе
1. Як визначити склад ядра атома і кількість електронів навколо нього? Кількість протонів в ядрі атома дорівнює порядковому номеру елемента. Кількість протонів дорівнює кількості електронів. Щоб визначити кількість нейтронів в ядрі атома, потрібно обчислити різницю між нуклонним числом (відносною атомною масою елемента) і протонним числом (порядковим номером елемента).
2. Чому дорівнює кількість електронів на зовнішньому енергетичному рівні в атомах елементів головних підгруп? Дорівнює номеру групи періодичної системи, в якій елемент перебуває.
3. Як визначити вищу валентність елемента? За номером групи періодичної системи, в якій елемент перебуває.
4. Як визначити число енергетичних рівнів у атомі? За номером періоду періодичної системи, в якій елемент перебуває.
5. Де в періодичній системі розташовані неметалічні елементи? У довгому варіанті періодичної системи є ламана лінія, проведена від Бору до Астату, ліворуч від неї перебувають металічні елементи, а праворуч - неметалічні.
6. Де в періодичній системі зазначено формули вищих оксидів і летких сполук елементів з Гідрогеном? Під кожною групою періодичної системи зазначено формули вищих оксидів, а для елементів IV-VII груп - формули летких сполук з Гідрогеном.
7. Як визначити валентність елемента у леткій сполуці з Гідрогеном? За правилом: валентність елемента у леткій сполуці з Гідрогеном дорівнює різниці числа 8 і номера групи, в якій елемент перебуває.
8. Як визначити хімічний характер оксиду та гідрату оксиду елемента? За положенням елемента в періодичній системі. Оксиди і гідрати оксидів, утворені елементами одного періоду, поступово змінюють хімічний характер від основних через амфотерні до кислотних.
9. Як у періодах і групах змінюються металічні та неметалічні властивості, радіус атома хімічних елементів? Металічні властивості елементів у періодах послаблюються зліва направо, а у підгрупі посилюються зверху донизу періодичної системи. Неметалічні властивості елементів у періодах посилюються зліва направо, а у підгрупах - знизу догори періодичної системи. Радіуси атомів елементів у періоді зменшуються зліва направо, а у підгрупі зростають зверху донизу періодичної системи.

Радіуси атомів залежать від кількості енергетичних рівнів, на яких розміщені електрони, і зарядів ядер (кількості електронів). У періоді зі збільшенням порядкового номера хімічного елемента заряд ядра поступово зростає, кількість електронів поступово теж зростає і електрони приитягуються до ядра сильніше, і тому в періоді радіус атомів поступово зменшується. У підгрупах із зростанням заряду ядра елемента збільшується число енергетичних рівнів в атомі, тому радіус атомів елементів зростає.
Застосуйте свої знання й уміння
Вправа 1. Складіть план характеристики хімічного елемента за його положенням у періодичній системі й схарактеризуйте за ним будь-які два з перших двадцятьох елементів періодичної системи. Відповідь оформіть як таблицю.
План характеристики хімічного елемента.
1. Розміщення в періодичній системі.
Порядковий номер елемента, його відносна атомна маса, у якому періоді, групі, підгрупі перебуває елемент.
2. Будова атома.
Заряд ядра та його склад (кількість протонів, нейтронів), кількість електронів, енергетичних рівнів і розподіл в них електронів. Графічне зображення будови зовнішнього енергетичнго рівня, формула електронної конфігурації.
3. Характер хімічного елемента.
s-,p-,d-,f-елемент, металічний чи неметалічний елемент, проста сполука.
4. Характеристика сполук.
Вищий оксид, валентність елемента в ньому, характер оксиду. Гідрат вищого оксиду та його характер. Сполука Гідрогену і валентність в ній.
5. Порівняння властивостей елемента із властивостями його сусідніх елементів.
| Магній | Флуор |
|
1. Порядковий номер 12, Ar(Mg)=24, 3-тій період, ІІ група, головна підгрупа. |
1. Порядковий номер 9, Ar(F)=19, 2-ий період, VІІ група, головна підгрупа |
|
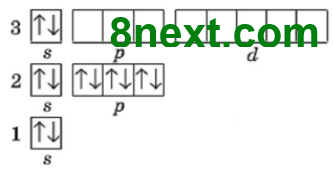
2. Заряд ядра +12, містить 12 протонів, 12 нейтронів (24-12=12), 12 електронів. Електронна оболонка складається з трьох енергетичних рівнів. На зовнішньому рівні міститься одна електронна пара. Будова зовнішнього електронного рівня:
Електронна формула: 1s22s22p63s2 |
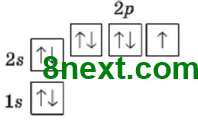
2. Заряд ядра +9, містить 9 протонів, 10 нейтронів (19-9=10), 9 електронів. Електронна оболонка складається з двох енергетичних рівнів. На зовнішньому рівні міститься три електронні пари і 1 неспарений електрони. Будова зовнішнього електронного рівня:
Електронна формула: 1s22s22p5 |
|
3. s-елемент, металічний, для набуття електронної конфігу- рації найближчого інертного елемента втрачає 2 електрони, проста речовина - метал магній. |
3. р-елемент, неметалічний, для набуття електронної конфігура- ції найближчого інертного еле- мента приєднує 1 електрон, проста речовина - неметал фтор |
|
4. Формула вищого оксиду MgО, вища валентність ІІ, основний оксид. Ве(ОН)2, основа. Леткої сполуки з Гідрогеном не утворює. |
4. Формула вищого оксиду Cl2О7, вища валентність VІІ, кислотний оксид. HCl, кислота. Летка сполука HCl, валентність Хлору І (8-7=1) |
|
5. Металічні властивості виражені сильніше, ніж у Берилію і Алю- мінію, але слабше, ніж у Літію і Магнію. |
5. Найактивніший неметалічний елемент.
|
Вправа 2. Порівняйте Натрій і Хлор за їхнім положенням у періодичній системі. Чим вони подібні й чим відмінні?
Подібні: перебувають в одному періоді (третьому).
Відмінні: Натрій і Хлор перебувають у різних групах головних підгрупах (І і VІI відповідно), тому різним є характер елемента (металічний і неметалічний), властивості простої речовини (типовий метал і типовий неметал), характер оксиду (основний і кислотний), гідрату оксиду (основа і кислота), сполуки з Гідрогеном (тверда речовина і летка), різною є вища валентність елементів (І і VII відповідно), є елементами різних природних родин (лужним елементом і галогеном).