Інші завдання дивись тут...
© 8next.com (відповіді, перероблене і доповнене)
Експериментуймо
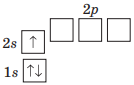
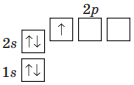
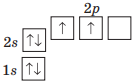
Узявши до уваги, що кожний електрон намагається зайняти вільну орбіталь під рівня, а в разі її відсутності «підселяється» в орбіталь до іншого електрона, складіть електронні формули атомів Нітрогену, Оксигену, Флуору та Неону, а також зобразіть графічні варіанти цих формул.
|
Назва
елемента
|
Електронна
формула
|
Графічний
варіант
|
| Нітроген |
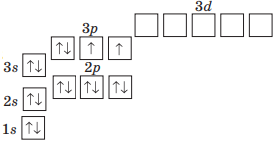
7N 1s22s22p3 або 7N [He]2s22p3 |
 |
| Оксиген |
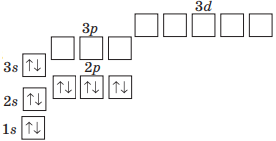
8O 1s22s22p4 або 8O [He]2s22p4 |
 |
| Флуор |
9F 1s22s22p5 або 9F [He]2s22p5 |
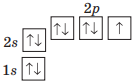 |
| Неон |
10N 1s22s22p6 або 10Ne [He]2s22p6 |
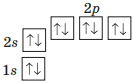 |
Думаймо
Запропонуйте гіпотезу, чому розміри атомів хімічних елементів у періоді зменшуються, а не збільшуються.
Зменшення розмірів атомів хімічних елементів у періоді зумовлене тим, що із зростанням зарядів ядра атома, притягування зовнішніх електронів до ядра зростає і зменшується радіус атома.
Експериментуймо
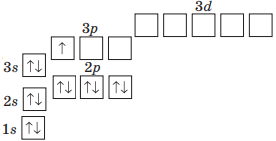
Складіть електронні формули атомів решти хімічних елементів 3–го періоду.
Магній 12Mg 1s22s22p63s2 або [Ne]3s2
Алюміній 13Al 1s22s22p63s23p1 або [Ne]3s23p1
Силіцій 14Si 1s22s22p63s23p2 або [Ne]3s23p2
Фосфор 15P 1s22s22p63s23p3 або [Ne]3s23p3
Сульфур 16Si 1s22s22p63s23p4 або [Ne]3s23p4
Хлор 17Cl 1s22s22p63s23p5 або [Ne]3s23p5
Аргон 18Ar 1s22s22p63s23p6 або [Ne]3s23p6
Експериментуймо
Запишіть електронну формулу атома елемента № 20 Кальцію.
20Са 1s22s22p63s23p64s2 або [Ar]4s2
Думаймо
До s– чи р–елементів належать Сульфур, Барій, Калій, Неон, Йод?
Сульфур S належить до р–елемента, Барій Ba — s–елемента, Калій K — s–елемента, Неон Ne — р–елемента, Йод I — р–елемента.
Думаймо
Назвіть неметалічні елементи 1—2–го періодів, які є винятками.
Атом Гідрогену Н має 1 зовнішній електрон, а атом Гелію Не має 2 зовнішні електрони, але належать до неметалічних елементів.
Сформулюйте цікаве запитання за темою параграфа і поставте його своїм однокласникам/однокласницям.
До s– чи р–елементів належать Літій і Хлор?
Літій Li належить до s–елемента, а Хлор Cl — р–елемента.
ВАШІ ДОСЯГНЕННЯ І ВІДКРИТТЯ
Вправа 309
Назвіть елемент, атом якого має таку електронну формулу:
а) 1s22s22p63s23p2;
Сума електронів у записі електронної формули атома елемента чисельно дорівнює його порядковому номеру, тому знаходимо суму електронів і визначаємо відповідний елемент. Всього 14 (2+2+6+2+2=14) електронів, тому порядковий номер 14. Цим хімічним елементом є Силіцій (Si);
б) [Нe]2s22p5;
Електронна формула зовнішнього енергетичного рівня ...2s22p5. Заповнюється другий енергетичний рівень, значить, елемент розташований у 2–му періоді. На зовнішньому енергетичному рівні атома 7 (2+5=7) електронів, отже, елемент розташований у VІІ групі, це р–елемент, тому — в головній підгрупі. Шукаємо в Періодичній таблиці клітинку на перетині 2–го періоду й VII групи. Цим хімічним елементом є Флуор (F);
в) [Ar]4s2.
Електронна формула зовнішнього енергетичного рівня ...4s2. Заповнюється четвертий енергетичний рівень, значить, елемент розташований у 4–му періоді. На зовнішньому енергетичному рівні атома 2 електрони, отже, елемент розташований у ІI групі, це s–елемент, тому — в головній підгрупі. Шукаємо в Періодичній таблиці клітинку на перетині 4–го періоду й II групи. Цим хімічним елементом є Кальцій (Са).
Вправа 310
Атом на другому енергетичному рівні має 6 електронів. Скільки серед них спарених, а скільки — неспарених?
Із шести електронів на останньому (другому) енергетичному рівні є 2 s–електрони, які є спареними, тому 4 (6–2=4) електрони є р–електронами, з яких 3 р–електрони неспарені і 1 р–електрон спарений. Отже, разом є 2 спарених і 3 неспарених електрони.
Вправа 311
Атоми яких елементів 2–го періоду мають один неспарений електрон, два неспарені електрони?
Один неспарений електрон мають атоми таких хімічних елементів 2–го періоду:
Літій, Бор, Флуор.
Два неспарені електрони мають атоми таких хімічних елементів 2 періоду:
Карбон, Оксиген.
Вправа 312
Укажіть хімічний елемент, електронну будову атома якого описує така графічна формула:
Графічна формула містить три енергетичні рівні, значить, елемент розташований у 3–му періоді. На останньому енергетичному рівні є 2 s–електрони та 1 р–електрон, разом 3 зовнішні електрони, отже, елемент розташований у ІІІ групі, це р–елемент, тому — в головній підгрупі. Шукаємо в Періодичній таблиці клітинку на перетині 3–го періоду й ІІІ групи. Цей елемент — Алюміній Al.
Графічна формула містить три енергетичні рівні, значить, елемент розташований у 3–му періоді. На останньому енергетичному рівні є 2 s–електрони та 4 р–електрони, разом 6 зовнішніх електронів, отже, елемент розташований у VІ групі, це р–елемент, тому — в головній підгрупі. Шукаємо в Періодичній таблиці клітинку на перетині 3–го періоду й VІ групи. Цей елемент — Сульфур S.
Вправа 313
Укажіть помилки в електронних формулах атомів:
а) 1s22s32p1;
Максимальна кількість s–електронів може бути 2, тому помилка в кількості s–електронів на другому енергетичному рівні атома елемента. Отже, правильна формула має вигляд 1s22s22p1.
б) [Ar]3s23p2;
Останнім є третій енергетичний рівень, тому в дужках має бути хімічний елемент, атом якого в електронній оболонці містить два енергетичні рівні, тобто є елементом другого періоду і міститься в головній підгрупі VIII групи. Хімічний елемент Аргон міститься в 3–ому періоді, тому в дужках має бути символ Ne — хімічний елемент другого періоду. Отже, правильна формула має вигляд [Ne]3s23p2.
в) 1s22s22p63s13p4.
Максимальна кількість s–електронів може бути 2, тому помилка в кількості s–електронів на третьому енергетичному рівні. Отже, правильна формула має вигляд 1s22s22p63s23p4.
Вправа 314
Скориставшись періодичною таблицею, з’ясуйте:
а) яких елементів більше — p–елементів чи d–елементів;
У періодичній таблиці р–елементи перебувають у головних підгрупах III – VIII груп, а d–елементи — у побічних підгрупах I – VIII груп. Тому очевидним є те, що d–елементів є більше, ніж р–елементів.
б) які елементи — металічні чи неметалічні — переважають серед s–елементів, p–елементів.
Серед s–елементів переважають металічні елементи, бо це хімічні елементи I i II групи, а також побічних підгруп I – VIII груп.
Серед р–елементів переважають неметалічні елементи, бо це хімічні елементи головної підгрупи III – VIII груп.
Вправа 315*
Назвіть два елементи, в атомах яких кількість електронів у всіх s–орбіталях така сама, що й у р–орбіталях.
Оксиген. Електронна формула 1s22s22p4 , отже, має 4 s–електрони і 4 р–електрони.
Магній. Електронна формула 1s22s22p63s2, отже, має 6 s–електронів і 6 р–електронів.
Вправа 316
Випишіть ключові слова і словосполучення з тексту параграфа для укладання двомовного словничка.
Зовнішні електрони — outer electrons, s–елементи — s–elements, p–елементи — р–elements.
––––––––– ПРОГРАМА 2016 року і 2021 року ––––––––––
§7 / §6. ЕЛЕКТРОННА БУДОВА АТОМІВ
Вправа 46 / 37 (2021)
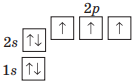
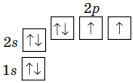
Атом елемента 2–го періоду на останньому енергетичному рівні має 6 електронів. Скільки серед них спарених електронів, а скільки — неспарених? 4 спарених і 2 неспарених.
Цим атомом є Оксиген, электронна формула якого 1s22s22p4, а графічна має вигляд:

Із 6 електронів на останньому (2) енергетичному рівні є 2 s–електрони, які є спареними, та 4 р–електрони, з яких 2 р–електрони спарені і 2 р–електрони неспарені, разом є 4 спарених і 2 неспарених електрони.
Вправа 47 / 38 (2021)
Атоми яких елементів 2–го періоду мають:
а) один неспарений електрон; Літій, Бор, Флуор
|
Літій 1s22s1
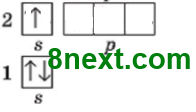
|
Бор 1s22s22p1

|
Флуор F 1s22s22p5
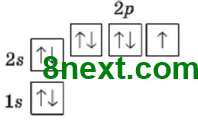
|
б) два неспарені електрони? Карбон, Оксиген
|
Карбон 1s22s12p2
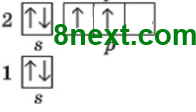
|
Оксиген 1s22s22p4

|
Вправа 39 (2021)
Назвіть елемент, атом якого має таку електронну формулу:
а) 1s2; Гелій
Сума електронів у записі електронної формули атома елемента чисельно дорівнює його порядковому номеру, тому знаходимо суму електронів і визначаємо відповідний елемент. Всього 2 електрони, тому №2 — це Гелій;
б) 1s22s22p63s1; Натрій
Сума електронів у записі електронної формули атома елемента чисельно дорівнює його порядковому номеру, тому знаходимо суму електронів і визначаємо відповідний елемент. Всього 11 (2+2+6+1=11) електронів, порядковий №11 — це Натрій;
в) [He]2s22p5; Флуор
Електронна формула зовнішнього енергетичного рівня ...2s22p5. Заповнюється другий рівень, значить, елемент розташований у 2–му періоді. В атомі елемента на зовнішньому енергетичному рівні 7 (2+5=7) електронів, отже, елемент розташований у VІІ групі, це р–елемент, тому — в головній підгрупі. Шукаємо в Періодичній таблиці клітинку на перетині 2–го періоду й VII групи. Цей елемент — Флуор;
г) [Ne]3s2. Магній
Електронна формула зовнішнього енергетичного рівня ...3s2. Заповнюється третій рівень, значить, елемент розташований у 3–му періоді. В атомі елемента на зовнішньому енергетичному рівні 2 електрони, отже, елемент розташований у ІI групі, це s–елемент, тому — в головній підгрупі. Шукаємо в Періодичній таблиці клітинку на перетині 3–го періоду й II групи. Цей елемент — Магній.
Вправа 48
Назвіть елемент, атом якого має таку електронну формулу:
а) 1s2; Гелій
Сума електронів у записі електронної формули атома елемента чисельно дорівнює його порядковому номеру, тому знаходимо суму електронів і визначаємо відповідний елемент. Всього 2 електрони, тому порядковий №2 — це Гелій;
б) 1s22s22p63s1; Натрій
Сума електронів у записі електронної формули атома елемента чисельно дорівнює його порядковому номеру, тому знаходимо суму електронів і визначаємо відповідний елемент. Всього 11 (2+2+6+1=11) електронів, тому порядковий №11 — це Натрій;
в) [He]2s22p5; Флуор
Електронна формула зовнішнього енергетичного рівня ...2s22p5. Заповнюється другий рівень, значить, елемент розташований у 2–му періоді. В електронній оболонці атома елемента на зовнішньому енергетичному рівні 7 (2+5=7) електронів, отже, елемент розташований у VІІ групі, це р–елемент, тому — в головній підгрупі. Шукаємо в Періодичній таблиці клітинку на перетині 2–го періоду й VII групи. Цей елемент — Флуор;
г) [Ne]3s1. Натрій
Електронна формула зовнішнього енергетичного рівня ...3s1. Заповнюється третій рівень, значить, елемент розташований у 3–му періоді. В електронній оболонці атома елемента на зовнішньому рівні 1 електрон, отже, елемент розташований у І групі, це s–елемент, тому — в головній підгрупі. Шукаємо в Періодичній таблиці клітинку на перетині 3–го періоду й I групи. Цей елемент — Натрій.
Вправа 49 / 40 (2021)
Назвіть два елементи, в атомах яких кількість усіх s– і всіх р–електронів однакова.
Оксиген. Електронна формула 1s22s22p4 містить 4 s–електрони і 4 р–електрони
Магній. Електронна формула 1s22s22p63s2 містить 6 s–електронів і 6 р–електронів
Вправа 41 (2021)
Укажіть хімічний елемент, електронну будову атома якого описує графічна формула в підручнику.
а) Aлюміній Аl
Графічна формула містить три енергетичні рівні, значить елемент розташований у 3–му періоді. На останньому (3) енергетичному рівні є 2 s–електрони та 1 р–електрон, разом три зовнішні електрони, отже, елемент розташований у ІІІ групі, це р–елемент, тому — в головній підгрупі. Шукаємо в Періодичній таблиці клітинку на перетині 3–го періоду й ІІІ групи. Цей елемент — Алюміній Al.
б) Сульфур S
Графічна формула містить три енергетичні рівні, значить елемент розташований у 3–му періоді. На останньому (3) енергетичному рівні є 2 s–електрони та 4 р–електрони, разом шість зовнішніх електронів, отже, елемент розташований у VІ групі, це р–елемент, тому — в головній підгрупі. Шукаємо в Періодичній таблиці клітинку на перетині 3–го періоду й VІ групи. Цей елемент — Сульфур S.
Вправа 50
Яке значення валентності може мати елемент, якщо його атом має електронну формулу:
а) 1s22s22p63s23p3; Три
В електронній формулі на останньому (3) енергетичному рівні є 2 s–електрони, які є спареними, та 3 р–електрони, які є неспареними. На можливе значення валентності елемента вказує кількість неспарених електронів в електронній оболонці атома, тому може бути валентність три;
б) [Ne]3s23p5? Один
В електронній формулі на останньому (3) енергетичному рівні є 2 s–електрони, які є спареними, та 5 р–електронів, з яких 4 р–електрони є спареними і 1 р–електрон — неспареним. На можливе значення валентності елемента вказує кількість неспарених електронів в електронній оболонці атома, тому може бути валентність один.
Інші завдання дивись тут...