Вправа 60 / 52 (2021)
За планом, наведеним у параграфі, охарактеризуйте:
План характеристики хімічного елемента:
1. Назва і символ хімічного елемента, його місце в періодичній системі (номер періоду, номер групи, головна чи побічна підгрупа).
2. Відносна атомна маса.
3. Склад атома, тобто кількість у ньому протонів, електронів і нейтронів (якщо елемент належить до двадцяти елементів, які мають по одному природному нукліду: Be, F, Na, Al, P, Sc, Mn, Co, As, Y, Nb, Rb, I, Cs, Pr, Tb, Ho, Tm, Au, Bi).
4. Електронна будова атома, тобто розміщення електронів на енергетичних рівнях і підрівнях.
5. Тип елемента (s-,p-,d-,f-), його хімічний характер (металічний чи неметалічний є елемент).
6. Максимальне і мінімальне значення валентності (за номером групи періодичної системи).
7. Тип простої речовини (метал чи неметал), її назва.
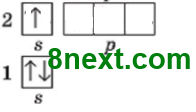
| а) Літій 1) Літій, Li, 2 період, І група, головна підгрупа. 2) Ar(Li)=7 3) №3, 7Li, N(p+)=3, N(e-)=3, N(N0)=7-3=4 4) Електронна формула: 1s22s1, aбо [Ne]2s1 Графічна формула:
5) s-елемент, металічний 6) постійна валентність І 7) метал, літій |
| б) Флуор
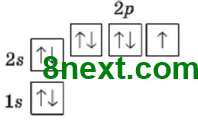
1) Флуор, F, 2 період, VII група, головна підгрупа. 2) Ar(F)=19 3) №9, 19F, N(p+)=9, N(e-)=9, N(n0)=19-9=10 4) Електронна формула: 1s22s22p5, або [He]2s22p5 Графічна формула:
5) p-елемент, неметалічний 6) постійна валентність І 7) неметал, фтор |
| Зміни 2021 року видання б) Оксиген
1) Оксиген, О, 2 період, VІ група, головна підгрупа. 2) Ar(O)=16 3) №8, N(p+)=8 N(e-)=8 4) Електронна формула: 1s22s22p6, або [He]2s22p6 Графічна формула:
5) р-елемент, неметалічний 6) валентність II 7) неметал, кисень. Утворює кілька простих речовин. |
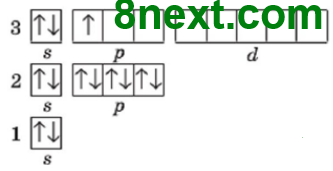
| в) Алюміній 1) Алюміній, Al, 3 період, ІІІ група, головна підгрупа. 2) Ar(Al)=27 3) №13, 27Al, N(p+)=13, N(e-)=13, N(n0)=27-13=14 4) Електронна формула: 1s22s22p63s23p1, або [Ne]3s23p1 Графічна формула:
5) р-елемент, металічний 6) постійна валентність ІІІ 7) метал, алюміній |
| г) Сульфур
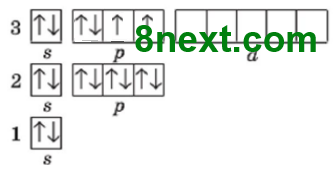
1) Сульфур, S, 3 період, VІ група, головна підгрупа. 2) Ar(S)=32 3) №16, N(p+)=16 N(e-)=16 4) Електронна формула: 1s22s22p63s23p4, або [Ne]3s23p4 Графічна формула:
5) р-елемент, неметалічний 6) змінна валентність: мінімальна ІІ, максимальна VI 7) неметал, сірка. Утворює кілька простих речовин. |
Вправа 61 / 53 (2021)
У поданому переліку вкажіть елементи, для яких не можна визначити кількість нейтронів у ядрі атома за відносною атомною масою: Na, Сl, Н, Аl, Fe.
Відповідь: не можна визначити для тих, що представлені ізотопами, тобто для Cl, H, Fe.
Перелік тих елементів, що не мають ізотопів дивись у п.3. плану вправи 60.
Вправа 62
Назвіть кілька елементів,максимальне значення валентності яких дорівнює 7. Відповідь: Хлор Сl, Бром Br, Йод I
Максимальне значення валентності елемента співпадає з номером групи, в якій він перебуває. Отже, це елементи VII групи головної підгрупи (виняток Флуор F, бо має постійну валентність І).
Вправа 63 / 54 (2021)
Назвіть кілька хімічних елементів, максимальні значення валентності яких не збігаються з номерами груп, де вони розміщені.
Оксиген О (максимальна валентність II, група VI),
Флуор (валентність I, група VII),
Нітроген (максимальна валентність IV, група V).
Врава 64 / 55 (2021)
Неметалічні елементи якої групи періодичної системи мають мінімальне значення валентності, що дорівнює 2? Назвіть ці елементи.
Відповідь: елементи VI групи — Оксиген O, Сульфур S, Селен Se, Телур Te
Мінімальне значення валентності неметалічних елементів обчислюється за правилом: 8 мінус номер групи, в якій перебуває елемент. Позначимо номер групи через х, тоді 8-х=2, звідси х=6, отже, це елементи VI групи.
Вправа 65 / 56 (2021)
У чому подібні водень і хлор — проста речовина елемента VII групи?
Прості речовини (гази) — складаються з двохатомних молекул: Н2 і Cl2
Чим відрізняється водень від натрію — простої речовини елемента І групи?
Молекула водню двохатомна, а натрію — ні. Водень — неметал, газоподібна речовина, а натрій — метал, тверда речовина.