Інші завдання дивись тут...
© 8next.com (відповіді, перероблене і доповнене)
Експериментуймо
Запишіть електронні формули частинок, що утворюються, і визначте їхні електричні заряди.
Кожний атом Літію втрачає один електрон і перетворюється на йон із зарядом +1, який позначається Li+.
Кожний атом Флуору приєднує один електрон і перетворюється на йон із зарядом –1, який позначається F–.
Думаймо
Чим зумовлений позитивний заряд катіона?
За рахунок віддачі атомом електрона зменшується негативний заряд електронної оболонки, але незмінним залишається заряд ядра. Тому катіон набуває позитивного заряду, величина якого визначається кількість відданих електронів.
Експериментуймо
Напишіть схему перетворення атома Магнію на відповідний йон і наведіть електронні формули обох частинок.
Mg – 2e– —> Mg2+ ;
aтом Mg — 1s22s22p63s2, або [Ne]3s2;
йон Mg+2 — 1s22s22p6, або [Ne].
Експериментуймо
Напишіть схему перетворення атома Оксигену на відповідний йон і наведіть електронні формули обох частинок.
O + 2e– –> O2–;
атом O — ls22s22p4, або [He]2s22p4;
йон O2– — ls22s22p6, або [Ne].
Думаймо
Чи пов'язана здатність атома втрачати/приєднувати електрони з його електронегативністю? Відповідь аргументуйте.
Так, здатність атома втрачати або приєднувати електрони безпосередньо пов'язана з його електронегативністю (ЕН). Висока електронегативність свідчить про здатність атома притягувати електрони, утворюючи аніони, що характерно для типових неметалічних елементів. Низька електронегативність свідчить про здатність атома віддавати електрони, утворювати катіони, що характерно для типових металічних елементів. Слід зазначити, що йонний зв’язок утворюється між атомами із суттєвою різницею електронегативності.
ВИОКРЕМЛЮЄМО ОСНОВНЕ
Сформулюйте цікаве запитання за темою параграфа і поставте його своїм однокласникам/однокласницям.
Атом якого єдиного неметалічного елемента може перетворитися не лише на аніон, а й на катіон?
Атом Гідрогену може перетворитися не лише на аніон Н–, а й на катіон Н+.
ВАШІ ДОСЯГНЕННЯ І ВІДКРИТТЯ
Вправа 382
Яка частинка містить більше електронів:
а) атом чи відповідний катіон;
Оскільки катіон — це заряджена частинка, що утворюється з атома внаслідок втрати ним електрона, тому більше електронів містить атом.
б) атом чи відповідний аніон?
Оскільки аніон — це заряджена частинка, що утворюється з атома внаслідок приєднання ним електрона, тому більше електронів містить аніон.
Вправа 383
Укажіть, який з елементів — Кальцій чи Нітроген — може утворювати катіон, а який — аніон. Визначте заряд кожного йона і напишіть хімічні формули цих частинок.
Атому Кальцію для завершення зовнішнього енергетичного рівня, потрібно віддати два електрони, тому віддаючи їх, він перетворюється на йон із зарядом +2, який називається катіоном Кальцію і позначається Са2+.
Атому Нітрогену для завершення зовнішнього енергетичного рівня потрібно приєднати три електрони, тому приєднуючи їх, він перетворюється на йон із зарядом -3, який називається аніоном Нітрогену і позначається N3–.
Вправа 384
Складіть електронні формули йонів Be2+ і S2–.
| Йон Be2+ — 1s2 або [He] |
Йон S2– — 1s22s22p63s23p6 або [Ar] |
Вправа 385
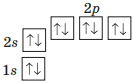
Атом якого хімічного елемента має таку саму електронну будову, що і йон Алюмінію? Складіть електронну формулу частинки та зобразіть її графічний варіант.
Йон Алюмінію утворюється віддаванням атомом трьох електронів, набуваючи при цьому електронну будову атома хімічного елемента Неону.
Електронна формула йона Al3+ — 1s22s22p6, або [Ne].
Графічна формула йона Al3+:
Вправа 386
В атомі якого елемента міститься на 2 електрони менше, ніж у йоні Магнію?
Запишемо електронну формулу йона Мg2+ — 1s22s22p6.
Йон Mg2+ містить 10 електронів (2+2+6=10), а атом невідомого хімічного елемента повинен містити 8 (10–2=8) електронів й, відповідно, 8 протонів, тобто мати порядковий номер, що дорівнює 8. Цим хімічним елементом є Оксиген.
Вправа 387
Укажіть у поданому переліку частинку з найбільшим радіусом і найменшим радіусом: атом Ne, йони Na+, Mg2+, F–. Відповідь обґрунтуйте.
У поданому переліку частинок найбільший радіус має йон F⁻, а найменший — йон Mg2+, оскільки всі частинки мають 10 електронів, як атом Неону, але із зростанням заряду ядра від –1 для йона F⁻ до +2 для йона Mg2+, зростає притягання електронів до ядра, зменшуючи розмір радіуса частинок.
Вправа 388
Напишіть хімічні формули частинок, у яких електронна будова зовнішнього енергетичного рівня — 3s23p6.
Таку зовнішню електронну будову має атом хімічного елемента Аргон, який розміщений у 3 періоді, тому такими частинками можуть бути катіони атомів металічних елементів, що містяться в 4–му періоді і аніони атомів неметалічних елементів, що містяться в 3–му періоді періодичної системи.
Отже, хімічні формули частинок: K+, Ca2+, Si4–, P3–, S2–, Cl–.
Вправа 389
Складіть електронну формулу частинки, яка має 8 протонів і 10 електронів. Назвіть цю частинку.
Атом хімічного елемента Оксиген, що має порядковий номер 8, приєднав два (10–8=2) електрони і перетворився на аніон Оксигену. Отже, цією частинкою є аніон О2–.
Вправа 390
Допишіть у схеми утворення йонів знаки «плюс» або «мінус» і відповідну кількість електронів:
а) I … e– → I–;
I + e– → I–
атом I — 1s22s22p63s23p64s23d104p65s25p5, або [Kr]5s25p5
йон I– — 1s22s22p63s23p64s23d104p65s25p6, або [Xe]
б) Al … e– → Al3+.
Al –3 e– → Al3+.
атом Al — 1s22s22p63s23p1, або [Ne]3s23p1
йон Al3+ — 1s22s22p6, або [Ne]
Вправа 391
Напишіть схеми утворення катіона та аніона Гідрогену з атома. Яка частинка має найменший радіус — катіон, аніон чи атом Гідрогену? Чому?
| Схема утворення катіона Гідрогену |
Схема утворення аніона Гідрогену |
|
Н –е– → Н+
атом H — 1s1
йон H+ — 1s2, або [He]
|
Н +е– → Н–
атом H — 1s1
йон H– — 1s0
|
Оскільки розмір радіуса залежить від кількості електронів, а катіон Гідрогену — це заряджена частинка, яка утворюється з атома внаслідок втрати ним електрона, тому радіус катіона Н+ найменший, у порівнянні з атомом чи аніоном Н–.
Вправа 392*
Назвіть три катіони і два аніони, електронна будова яких така сама, що і йона F–.
Йон F– має електронну будову 1s22s22s6, або [Ne], тому це можуть бути катіони атомів металічних елементів, що містяться в 3 періоді та аніони атомів неметалічних елементів, що містяться в 2 періоді періодичної системи.
Отже, три катіони: Na+, Mg2+, Al3+ і два аніони: N3–, O2–.
Вправа 393
Слово «йон» походить від грецького «іон» (той, що йде). З’ясуйте, чому частинці дали таку назву.
Частинці дали таку назву, бо ці частинки, на відміну від нейтральних атомів, рухаються (йдуть) до протилежно заряджених електродів під дією електричного поля — позитивні до катода (kat–ion — той, що йде вниз), а негативні до анода (an–ion — той, що йде вгору). Термін ввів Майкл Фарадей, описуючи ці частинки в процесі електролізу.
Вправа 394
Випишіть ключові слова і словосполучення з тексту параграфа для укладання двомовного словничка.
Йон — ion, катіон — cation, аніон — anion.
––––––––– ПРОГРАМА 2016 року і 2021 року ––––––––––
§13 СТІЙКІСТЬ ЕЛЕКТРОННИХ ОБОЛОНОК. ЙОНИ
Вправа 79 / 70 (2021)
Що спільного в електронній будові атомів інертних елементів? Атоми інертних елементів на зовнішньому енергетичному рівні містять вісім електронів (виняток Гелій — два електрони).
Вправа 80 / 71 (2021)
Яка частинка містить більше електронів:
а) атом чи відповідний катіон? Атом
Бо катіон – це заряджена частинка, яка утворюється з атома внаслідок втрати ним електрона.
б) атом чи відповідний аніон? Аніон
Бо аніон – це заряджена частинка, яка утворюється з атома внаслідок приєднання ним електрона.
Вправа 81 / 72 (2021) Які з елементів — Rb, Br, Sr, N — здатні утворювати катіони, а які — аніони? Визначте заряд йона кожного елемента і напишіть хімічні формули цих частинок.
|
Катіон Rb+
|
Аніон Br– |
Катіон Sr2+ |
Аніон N3– |
Елементи Rb i Sr металічні, атоми яких містять на зовнішньому енергетичному рівні 1 і 2 електрони відповідно. Атоми металічних елементів мають на зовнішньому енергетичному рівні від 1 до 3 електронів і здатні втрачати їх, перетворюючись на катіони.
Запишемо схему перетворення цих атомів на катіони та електронні формули частинок:
Rb – e– → Rb+;
атом Rb — 1s22s22p63s23p64s23d104p65s1, або [Kr]5s1
йон Rb+ — 1s22s22p63s23p64s23d104p6, або [Kr]
Sr – 2e– → Sr2+;
атом Sr — 1s22s22p63s23p64s23d104p65s2, або [Kr]5s2
йон Sr2+ — 1s22s22p63s23p64s23d104p6, або [Kr]
Елементи Br i N неметалічні, атоми яких містять на зовнішньому енергетичному рівні 7 і 5 електроныв відповідно. Атоми неметалічних елементів мають від 4 до 7 електронів, здатні приєднувати додаткові електрони, перетворюючись на аніони.
Запишемо схему перетворення цих атомів на аніони та електронні формули частинок:
Br + e– → Br–;
атом Br — 1s22s22p63s23p64s23d104p5, або [Ar]4s23d104p5
йон Br– — 1s22s22p63s23p64s23d104p6, або [Kr]
N + 3e– → N3–;
атом N — 1s22s22p3, або [He]2s23p3
йон N3– — 1s22s22p6, або [Ne]
Вправа 82 / 73 (2021)
Складіть електронні формули йонів:
| Йон |
Електронні
формули
|
|
Ве2+
|
1s2, або [He]
|
|
Р3–
|
1s22s22p63s23р6, або [Ar]
|
|
F–
|
1s22s22p6, або [Ne]
|
|
K+
|
1s22s22p63s23p6, або [Ar]
|
Врава 83 / 74 (2021)
Назвіть три катіони і два аніони, електронна будова яких така сама, що і йона F–.
Йон F– має таку електронну будову 1s22s22s6, або [Ne], тому це можуть бути катіони атомів металічних елементів, що містяться в 3 періоді чи аніони атомів неметалічних елементів, що містяться в 2 періоді періодичної системи.
| Катіони: Na+, Mg2+, Al3+ |
Аніони: N3–, O2– |
Вправа 84 / 75 (2021)
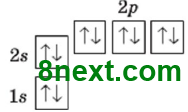
Який атом має таку саму електронну будову, що і йон Алюмінію? Атом Неону
Напишіть електронну формулу частинки та зобразіть її графічний варіант.
Електронна формула йону Алюмінію 1s22s22p6, або [Ne]
Графічна формула:
Вправа 85 / 76 (2021)
Напишіть хімічні формули частинок, у яких електронна будова зовнішнього енергетичного рівня — 3s23p6.
Таку електронну будову ...3s23р6 має атом Аргону, тому це можуть бути катіони атомів металічних елементів, що містяться в 4 періоді і аніони атомів неметалічних елементів, що містяться в 3 періоді періодичної системи.
| Ar |
K+ |
Ca2+ |
Si4– |
P3– |
S2– |
Cl– |
Вправа 86 / 77 (2021)
В атомі якого елемента міститься на 2 електрони менше, ніж у йоні Магнію? В атомі Оксигену.
Запишемо електронну формулу йона Магнію 1s22s22p6
З електронної формули бачимо, що йон Mg2+ містить 10 електронів (2+2+6=10), а атом невідомого елемента повинен містити 8 (10–2=8) електронів, а значить і протонів, тобто мати порядковий №8. Цим елементом є Оксиген.
Вправа 87 / 78 (2021)
Складіть електронну формулу частинки, яка має 16 протонів і 18 електронів. 1s22s22p63s23p6, або [Ar]
Назвіть цю частинку. Аніон Сульфуру S2–
На число протонів вказує порядковий номер елемента, тому це атом Сульфуру (№16). Число електронів на 2 більше, ніж протонів, отже, атом прийняв два електрони і перетворився на аніон із зарядом –2.
атом S — 1s22s22p63s23p4, або [Ne]3s23p4
йон S2– — 1s22s22p63s23p6, або [Ar]
Вправа 88 / 79 (2021)
Напишіть схеми утворення катіона й аніона Гідрогену з атома.
атом H — 1s1
Н –е– → Н+
катіон H+ — 1s0
Атом Н +е– → Н– аніон
аніон H– — 1s2, або He
Яка частинка має найменший радіус — катіон, аніон чи атом Гідрогену?
Катіон Гідрогену
Чому? Розмір радіуса залежить від числа енергетичних рівнів і кількості електронів, а катіон Гідрогену — це заряджена частинка, яка утворюється з атома внаслідок втрати ним електрона, тому радіус катіона Н+ найменший, а радіус аніона Н– майже не відрізняється від радіуса атома Гідрогену.
Вправа 89 / 80 (2021)
Укажіть у поданому переліку частинку з найбільшим радіусом і найменшим: атом Аг, йони К+, Са2+, Сl–. Найбільший радіус у йона Cl–, а найменший— у йона Ca2+.
Відповідь обґрунтуйте. Оскільки всі частинки мають 18 електронів, як атом Аргону, але із зростанням заряду ядра від –1 для йона Cl⁻ до +2 для йона Ca2+, зростає притягання електронів до ядра, зменшуючи розмір радіуса.
Інші завдання дивись тут...