Інші завдання дивись тут...
© 8next.com (відповіді, перероблене і доповнене)
Відшукаймо
Відшукайте в інтернеті температуру кипіння метану та порівняйте її з температурою кипіння води.
Температура кипіння метану –164,5°С. Температура кипіння води 100°С. Температура кипіння води є значно вищою у порівнянні з температурою кипіння метану.
Думаймо
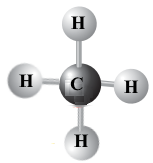
Спробуйте пояснити, чому між молекулами метану не утворюються водневі зв'язки, хоча ковалентний зв'язок С–Н є полярним. Скористайтеся моделлю молекули СН4.
Молекула метану має форму правильного тетраедру, де атом Карбону знаходиться в центрі, а атоми Гідрогену — у вершинах.
Молекула метану має симетричну будову, тому не дивлячись на те, що ковалентні зв'язки С–Н дещо полярні, їх симетричне розташування в молекулі не має виражених позитивних і негативних полюсів, тому вона неполярна і не є диполем, між якими утворюються водневі зв'язки.
Виконаймо вправу
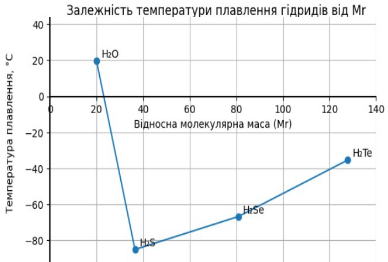
У таблиці наведено температури плавлення сполук елементів VI групи з Гідрогеном:
| Формула речовини |
Температура плавлення, °С |
|
Н2
H2S
H2Se
Н2Те
|
0
–85,6
–65,7
–51
|
За даними таблиці побудуйте графік залежності температур плавлення цих сполук від значень їхніх відносних молекулярних мас і прокоментуйте його.
Про що свідчить цей графік?
Цей графік свідчить про те, що температура плавлення води є значно вища у порівнянні з температурами плавлення решти сполук. Це пояснюється наявністю у воді, на відміну від решти наведених сполук, водневого зв'язку. Для розірвання цієї додаткової взаємодії потрібна додаткова енергія, тому температура плавлення води є значно вищою у порівнянні з температурою плавлення решти сполук.
Сформулюйте цікаве запитання за темою параграфа і поставте його своїм однокласникам/однокласницям.
Чи є молекула сірчистого газу (SO2) полярною молекулою (диполем)?
Молекула сірчистого газу має кутову форму (кут між зв'язками ~119°), тому ковалентні полярні зв'язки між атомами Сульфуру та Оксигену в молекулі мають виражені позитивний і негативний полюси, отже, молекула полярна і є диполем.
ВАШІ ДОСЯГНЕННЯ І ВІДКРИТТЯ
Вправа 374
Поясніть, чому молекула води є полярною.
У молекулі води з боку атома Оксигену зосереджується негативний заряд δ–, з боку атомів Гідрогену — позитивний заряд δ+, причому обидва атоми Гідрогену розміщені по один бік від атома Оксигену, бо молекула має кутову форму, тому молекула має два електричні полюси, її називають диполь («ди» — два, «поль» — полюс, тобто два полюси: + і –) і говорять, що вона полярна.
Вправа 375
Прокоментуйте утворення водневого зв’язку у воді та льоді.
Молекули–диполі води притягуються одна до одної внаслідок електростатичної взаємодії між атомами Гідрогену та Оксигену різних молекул, утворюючи водневий зв'язок. Щомиті водневі зв'язки у рідинах (воді) розриваються й одночасно утворюються нові, а в твердих речовинах (лід) не розриваються. Між молекулами Н2О у льоді є порожнини. Частина їх під час танення льоду поступово заповнюється «звільненими» молекулами, і рідина, що утворюється, трохи «ущільнюється». Тому лід у воді не тоне (легший за воду), тобто має меншу густину, ніж вода.
Вправа 376
Іноді кажуть, що водневий зв’язок коректніше називати гідрогеновим зв’язком. На чому ґрунтується ця думка?
Ця думка ґрунтується на тому, що водневим зв'язком називають електростатичну взаємодію між молекулами за участю атомів Гідрогену, тобто обв'язкова умова його утворення — наявність у молекулі речовин атомів Гідрогену.
Вправа 377*
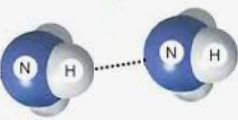
Молекула амоніаку NH3 має форму трикутної піраміди. Зобразіть поряд графічні формули двох молекул амоніаку та позначте водневий зв’язок між цими частинками. Чому цей зв’язок є в рідкій і твердій речовині, але не утворюється в газуватому амоніаку?
У молекулі амоніаку NH3 водневий зв'язок утворюється між частково позитивно зарядженим атомом Гідрогену однієї молекули та між частково негативно зарядженим атомом Нітрогену іншої молекули.
У газуватому амоніаку водневий зв'язок не утворюється, бо молекули знаходяться на великій відстані одна від другої і рухаються хаотично.
Вправа 378
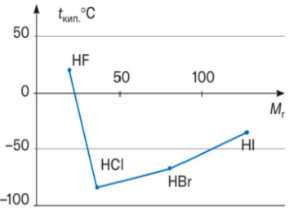
Графік, зображений на малюнкe, свідчить про аномально високу температуру кипіння речовини HF порівняно з речовинами подібного складу і будови. Поясніть цей факт.
Усі молекули цих речовин є диполями, але між молекулами–диполями речовини HF, на відміну від решти наведених сполук, виникає водневий зв'язок. Для розірвання цієї додаткової взаємодії потрібно додаткова енергія і цим пояснюється аномально висока температура речовини HF.
Вправа 379
За відомостями з інтернету з’ясуйте, яку температуру плавлення мав би лід, а яку температуру кипіння — вода в разі відсутності водневого зв’язку між молекулами. Який вигляд мала б тоді наша планета?
У разі відсутності водневого зв’язку між молекулами лід мав би набагато нижчу температуру плавлення від 0°C, близьку до температури плавлення аміаку (приблизно –80°C), а вода мала би набагато нижчу температуру кипіння від 100°C, близьку до температури кипіння сірководню (приблизно –60°C).
У разі відсутності водневого зв'язку, на нашій планеті за звичайних умов вода була б не в рідкому, а в газоподібному стані, як сірководень.
Вправа 380
Випишіть ключові слова і словосполучення з тексту параграфа для укладання двомовного словничка.
Водневий зв'язок — Hydrogen bond, диполь — dipole, полярність молекули — polarity of the molecule.
––––––––– ПРОГРАМА 2021 року––––––––––
§32 УЗАГАЛЬНЕННЯ ЗНАНЬ ПРО ОСНОВНІ КЛАСИ СПОЛУК
Вправа 250
Запиши формули оксидів у відповідні стовпчики таблиці:
|
Основні
оксиди
|
Амфотерні
оксиди
|
Кислотні
оксиди
|
|
Ag2O
ВаO
|
PbO
Al2O3
ZnO
|
I2O5
SO3
|
Вправа 251 Знайдіть відповідність.
| Формула оксиду |
Тип оксиду |
|
1) МnО
2) МnO2
3) Мn2O7
|
а) амфотерний
б) основний
в) несолетворний
г) кислотний
|
Вправа 252
Із яких частинок складаються оксиди Кальцію, Алюмінію, Карбону. Оксиди Кальцію й Алюмінію ― йонні сполуки, тому складаються з йонів металічних елементів Кальцію Ca2+ і Алюмінію Al3+ та йонів Оксигену О2–. Оксид Карбону ― молекулярна сполука, молекула якої складається з атомів Карбону і Оксигену.
Вправа 253
Наведіть по одному прикладу кислот, молекули яких містять два, три, чотири, п'ять, шість, сім і вісім атомів.
Два атоми: HCl ― хлоридна кислота, основність I
Три атоми: H2S ― сульфідна кислота, основність II
Чотири атоми: HNO2 ― нітритна кислота, основність I
П'ять атомів: HNO3 ― нітратна кислота, основність I
Шість атомів: H2SO3 ― сульфітна кислота, основність II
Сім атомів: H2SO4 ― сульфатна кислота, основність II
Вісім атомів: H3PO4 ― ортофосфатна кислота, основність III
Вправа 254
Запишіть хімічні формули двох амфотерних гідроксидів, які мають найменшу молекулярну масу.
Be(OH)2, Al(OH)3
Вправа 255
Виберіть (підкреслені) у наведеному переліку формули солей і поясніть свій вибір: Pbl2, MgF2, CH4, Na2S, CIF. Солі ― це сполуки, які складаються з катіонів металічних елементів (Pb2+, Mg2+, Na+) і аніонів кислотних залишків.
Вправа 256
Співвідношення мас Силіцію, Оксигену та Гідрогену в сполуці, утвореній цими елементами, становить 7:16:1. Виведіть хімічну формулу сполуки. До якого класу неорганічних сполук вона належить і чому?
Відомо: m(Si):m(O):m(H)=7:16:1
Знайти: формулу сполуки–?, клас сполуки–?
Розв'язування:
Масове відношення хімічних елементів у речовині дорівнює відношенню їх відносних атомних мас, помножених на кількість атомів кожного елемента у речовині, тому
m(Si):m(O):m(H)=yAr(Si):zAr(O):xAr(H), де Ar(H)=1, Ar(Si)=28, Ar(O)=16, а x,y,z – число атомів кожного елемента.
Запишемо співвідношення числа атомів кожного елемента:
x:y:z=m(H)/Ar(H):m(Si)/Ar(Si):m(O)/Ar(O)=1/1:7/28:16/16=1:1/4:1=4:1:4.
Отже, формула сполуки H4SiO4
Відповідь: кислота H4SiO4
Вправа 257
Обчисліть об'єм газу хлороводню потрібно розчинити за нормальних умов в 1 л води, щоб виготовити хлоридну кислоту із масовою часткою НСl 20%?
Відомо: V(H2O)=1 л=1000 мл, w(HCl)=20%, або 0,2
Знайти: V(HCl)–?
Розв'язання
Обчислюємо масу води за формулою m=V•ρ, де густина води ρ(води)=1 г/мл.
m(H2O)=V(Н2О)•ρ(Н2О)=1000 мл • 1 г/мл=1000 г
З формули обчисленння масової частки w(речовини)=m(речовини)/(m(речовини)+m(води))
знаходимо масу розчиненої речовини:
m(речовини)=(m(речовини)+m(води))•w(речовини), звідси
m(речовини)=m(речовини)•w(речовини)+m(води)•w(речовини)
m(речовини)–m(речовини)•w(речовини)=m(води)•w(речовини)
m(речовини)(1–w(речовини)=m(води)•w(речовини)
m(речовини)=m(води)•w(речовини):(1–w(речовини))
m(HCl)=1000 мл•0,2:(1–0,2)
m(HCl)=1000 мл•0,2:0,8
m(HCl) =250 г
Обчислюємо кількість речовини хлоридної кислоти за формулою n=m/M, де M=Mrг/моль.
Mr(НCl)=Ar(H)+Ar(Cl)=1+35,5=36,5, M(НCl)=36,5 г/моль
n(HCl)=m(HCl):M(HCl)=250 г : 36,5 г/моль=6,85 моль
Обчислюємо об'єм хлоридної кислоти кількістю речовини 6,85 моль за формулою V=n•VV, де VV–постійна величина і за н.у. чисельно дорівнює 22,4 л/моль.
V(HCl)=v(HCl)•VM=6,85 моль • 22,4 л/моль=153,4 л
Відповідь: V(HCl)=153,4 л
––––––––– ПРОГРАМА 2016 року ––––––––––
§37 УЗАГАЛЬНЕННЯ ЗНАНЬ ПРО ОСНОВНІ КЛАСИ СПОЛУК
Вправа 296. Заповніть таблицю, записавши у відповідні колонки формули
|
Основні
оксиди
|
Амфотерні
оксиди
|
Кислотні
оксиди
|
|
Li2O,
Ag2O,
MgO
|
PbO,
Al2O3,
ZnO
|
Cl2O7,
SiO2,
SO2,
CrO3
|
Вправа 300. Запишіть хімічні формули амфотерних гідроксидів і вкажіть над символами металічних елементів їхні ступені окиснення.
Be+2(OH)2, Zn+2(OH)2, Al+2(OH)3, Fe+3(OH)3, Cr+3(OH)3 тощо.
Інші завдання дивись тут...