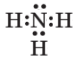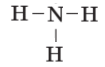© 8next.com (відповіді, перероблене і доповнене)
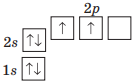
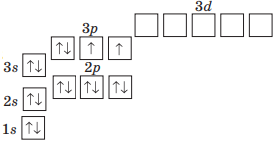
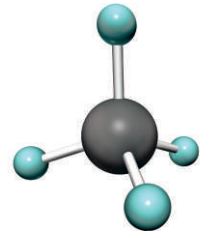
Вправа 335
|
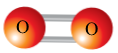
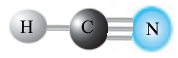
Повна електронна формула |
Графічна формула |
|
|
|
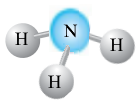
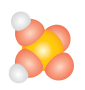
| Графічна формула |
|
|
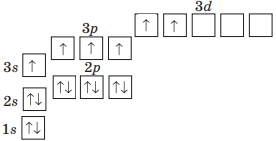
| Символ елемента | Колір кульок |
| Н | сірий |
| О | червоний |
| С | чорний |
| N | синій |
| S | жовтий |
 |
 |
 |
§2 ПЕРІОДИЧНИЙ ЗАКОН Д.І.МЕНДЕЛЄЄВА
Вправа 6
У фрагменті природного ряду елементів, який починається з Літію і закінчується Флуором, укажіть хімічний характер кожного елемента і тип його простої речовини. Який метал і який неметал серед цих простих речовин мають бути найактивнішими в хімічних реакціях?
|
Хімічні елементи |
Літій Li |
Берилій Be |
Бор B |
Карбон C |
Нітроген N |
Сульфур S |
Хлор Cl |
|
Хімічний характер елемента |
металіч- ний |
металіч- ний |
немета- лічний |
немета- лічний |
немета- лічний |
немета- лічний |
немета- лічний |
|
Тип простої речовини |
метал | метал | неметал | неметал | неметал | неметал | неметал |
|
Найактив- ніші прості речовини |
найактив- ніший метал |
найактив- ніший неметал |
Вправа 7
Поясніть значення слова «періодичність»? Які зміни у природі можна охарактеризувати цим словом? Зіставте за змістом слово «періодичність» зі словами «неперервність*, «поступовість».
Періодичність у хімії — це повторення (але не копіювання) хімічного характеру елементів, особливостей будови атомів, складу, будови і властивостей речовин через певну кількість елементів у їх природному ряду. У природі спостерігаємо поступову зміну пори року (зима, весна, літо, осінь), що періодично повторюється кожного року, поступову зміну дня і ночі, що періодично повторюється щодоби.
Вправа 8
Періодичною чи поступовою є зміна максимальних значень валентності елементів у їх природному ряду? Періодичною.
Ряд хімічних елементів, складений за зростанням атомних мас, Д.І.Менделєєв назвав природним рядом, тобто таким, що існує незалежно від людини в самій природі.
Відповідь проілюструйте прикладами. У межах кожного періоду (фрагменті природного ряду) спостерігаємо поступову зміну максимальних значень валентності елементів від I до VIII, що періодично повторюється у їх природному ряду.
| Валентність | I | II | III | IV | V | VI | VII |
|
Елементи 2 періоду |
Li | Be | B | C | N | O | F |
|
Елементи 3 періоду |
Na | Mg | Al | Si | P | S | Cl |
Вправа 9
Укажіть відмінність між сучасним формулюванням періодичного закону і тим, яке дав Менделєєв. У сучасному формулюванні властивості хімічних елементів, простих речовин, а також склад і властивості сполук перебувають у періодичній залежності від зарядів ядер атомів, а не від значень атомних мас, як сформулював Д.І.Менделєєв.