© 8next.com (відповіді, перероблене і доповнене), 2021
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
Вправа 1
Відомі підрівні: s-, p-, d-, f-підрівні.
Число підрівнів (а значить, і кількість форм орбіталей) залежить від енергетичного рівня і дорівнює його номеру.
Вправа 2
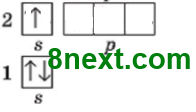
s-орбіталь має форму кулі (сферичну), p-орбіталь має форму об'ємної вісімки (гантелі, причому ядро атома міститься у місці звуження гантелі).
s- i p-підрівні утворені s- i p-електронами.
Вправа 3
Електрони характеризуються різним запасом енергії і залежно від цього розташовуються на різних віддалях від ядра атома, внаслідок чого утворюються різні енергетичні рівні. Електрони, що мають однаковий запас енергії, утворюють енергетичний рівень.
Вправа 4
Заповнення енергетичних рівнів відбувається поступово зі зростанням заряду ядра атома. Рівень, що має 2 або 8 електронів, є завершеним, а всі електрони в ньому — спарені.
Спареними електронами називаються електрони, які мають однакові характеристики (запас енергії, форму і орієнтацію в просторі), але різняться спіном.
Вправа 5
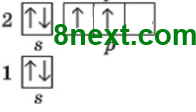
Порядок розташування електронів на орбіталях: електрон займає вільну орбіталь, а за відсутності вільної — утворює пару з іншим електроном у напівзаповненій орбіталі.
Вправа 6
На кількість енергетичних рівнів в атомі елемента вказує номер періоду, в якому він перебуває.
На кількість електронів на зовнішньому енергетичному рівні вказує номер групи, в головній підгрупі якої елемент перебуває.
Вправа 7.
|
Літій 1s22s1
|
Берилій 1s22s2
|
Бор 1s22s22p1
|
|
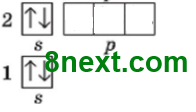
Карбон 1s22s22p2
|
Нітроген 1s22s22p3
|
Оксиген 1s22s22p4
|
Вправа 8
а) На кількість енергетичних рівнів вказує номер періоду, в якому перебуває елемент, тому в атомах елементів Берилію, Карбону, Магнію, Кальцію їх відповідно два, два, три, чотири.
б) На число електронів на зовнішньому енергетичному рівні вказує номер групи, в якій перебуває елемент, тому в атомах елементів Натрію, Алюмінію, Фосфору, Брому їх відповідно один, три, п'ять, сім.
Вправа 9
а) Літію та Натрію;
3Li 1s22s1 11Na 1s22s22p63s1
Спільне: нявність одного неспареного s-електрона на зовнішньому енергетичному рівні.
Відмінне: різною є кількість енергетичних рівнів (елементи 2 і 3 періодів), тип підрівнів (в атома Літію s-, а Натрію s-, p-підрівні) й відповідно форма орбіталей, загальна кількість електронів (3 в атома літію і 11 в атома Натрію).
б) Нітрогену й Фосфору;
Спільне: наявність п'ять електронів на зовнішньому енергетичному рівні (V група), з них, три неспарені p-електрони.
Відмінне: різною є кількість енергетичних рівнів (елементи 2 і 3 періодів), тип підрівнів (в атома Нітрогену s-, p-підрівні, а в атома Фосфора - s-, p-, d-підрівні, з них, d-підрівень заповнюється в елементів, починаючи з 4 періоду), загальна кількість електронів (7 в атома Нітрогену і 15 в атома Фосфору).
в) Гелію та Неону.
Спільне: наявність 8 електронів на завершеному зовнішньому енергетичному рівні (елементи VІІІ групи).
Відмінне: різною є кількість енергетичних рівнів (елементи 1 і 2 періодів), тип підрівнів (в атома Гелію s-підрівеь, а Неону ― s-, p-підрівні), загальна кількість електронів (2 в атома Гелію і 10 в атома Неону).