![]()
Сторінка 13
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
Вправа 1. Складіть електронну схему утворення молекули брому Вr2.
.. .. .. ..
:Br. + .Br: -> :Br:Br:
.. .. .. ..
Вправа 2. Порівняйте будову йонів Mg2+ і F– з будовою атома Неону Nе.
Порівняємо будову:
Mg2+ 1s22s22p6
F- 1s22s22p6
Ne 1s22s22s6
Подібні ознаки: однакова кількість енергетичних рівнів, загальне число електронів, кількість електронів на останньому енергетичному рівні.
Відмінні ознаки: різний заряд ядра, йони Mg2+ i F- - заряджені частинки, а атом Неону - електронейтральний.
Вправа 3. Напишіть електронні та графічні формули молекул сірководню Н2S та амоніаку NH3.
| Молекули | H2S | NH3 |
|
Електронні формули |
.. Н:S:Н ..
|
.. Н:N:Н .. Н |
|
Структурні формули |
Н—>S<—Н |
Н—>N<—Н ↑ Н |
Вправа 4. Скільки ковалентних зв’язків можуть утворювати в сполуках атоми Силіцію і Фосфору? У сполуках атоми Силіцію можуть утворювати два і чотири ковалентних зв'язки, а Фосфору - три і п'ять.
Відповідь обґрунтуйте. На число ковалентних зв'язків (спільних електронних пар) вказує валентність елементів, тому достатньо визначити можливі валентності запропонованих хімічних елементів.
Атом Силіцію:
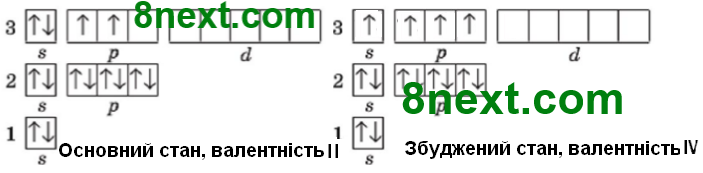
Валентність елемента дорівнює числу неспарених електронів в атомі. У основному стані атома Силіцію два неспарені електрони, тому валентність ІІ. В електронній оболонці атома Силіцію є вільні енергетичні комірки, тому електрони можуть із нижчих енергетичних рівнів чи підрівнів переміститися на вищі, таким чином атом з основного (незбудженого) стану переходить у збуджений, при цьому енергія завжди поглинається і спарені електрони стають неспареними, тобто стає чотири неспарених електронів, тому валентність Силіцію може бути ІV.
Атом Фосфору:
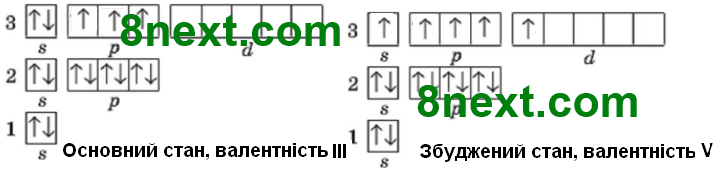
Валентність елемента дорівнює числу неспарених електронів в атомі. У основному стані атома Фосфору три неспарені електрони, тому валентність ІІІ. В електронній оболонці атома Феруму є вільні енергетичні комірки, тому електрони можуть із нижчих енергетичних рівнів чи підрівнів переміститися на вищі, таким чином атом з основного (незбудженого) стану переходить у збуджений, при цьому енергія завжди поглинається і спарені електрони стають неспареними, тобто стає п'ять неспарених електронів, тому валентність Фосфору може бути V.
Вправа 5. Назвіть вид хімічного зв’язку в сполуках, формули яких Н2, СО2, SіО2, О2, КCl, І2, Al2O3, NH3, P2O5, N2, HBr.
|
Ковалентний неполярний зв'язок |
Ковалентний полярний зв'язок |
Йонний зв'язок |
|
Н2, О2, І2, N2
|
СО2, SіО2, NH3, P2O5, HBr |
КCl, Al2O3
|
Ковалентний неполярний зв'язок виникає між атомами неметалічних елементів з однаковою електронегативністю, а ковалентний полярний - між атомами неметалічних елементів з різною електронегативністю. Йонний зв'язок виникає між атомами елементів, що суттєво відрізняються електронегативністю, тобто між типовими металічними і неметалічними елементами.
Сторінка 14
Додаткові завдання
Вправа 6. Напишіть рівняння реакцій сполучення та складіть електронні схеми цих реакцій:
а) літію з киснем:
4Li + O2 = 2Li2O
Li0 - 1e -> Li+;
O0 + 2e -> O2-;
Li+ + O2- -> Li2O;
4Li + O2 -> 4Li+ + 2O2-
б) алюмінію з сіркою:
2Al + 3S = Al2S3
Al0 - 3e -> Al3+;
S0 + 2e -> S2-;
Al3+ + S2- -> Al2S3;
2Al + 3S -> 2Al3+ + 3S2-
в) магнію з фосфором:
3Mg + 2P = Mg3P2
Mg0 - 2e -> Mg2+;
P0 + 3e -> P3-;
Mg2+ + P3- -> Mg3P2;
3Mg + 2P -> 3Mg2+ + 2P3-
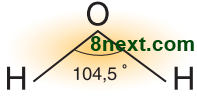
Вправа 7. Напишіть молекулярну, електронну та графічну формули води. Обґрунтуйте склад і кутову будову молекули води.
|
Молекулярна формула |
електронна формула |
графічна формула |
| Н2О | Н:О:Н |
|
Молекула води Н2О складається з двох атомів Гідрогену і одного атома Оксигену.
Ковалентні полярні зв'язки в молекулі води утворюються за рахунок двох неспарених р-електронів атома Оксигену, що містяться на окремих двох р-орбіталях, та s-електронів атомів Гідрогену. Дві р-орбіталі направлені вздовж осей координат - х, у, розміщені під кутом 900. Ядра атомів Гідрогену позитивно заряджені (однойменні), тому частково відштовхуються і кут збільшується до 104,50.
Вправа 8. Поясніть, чому молекули галогенів складаються з двох атомів, а не з трьох або чотирьох. Відповідь мотивуйте. У електронній оболонці атома галогенів на останньому енергетичному рівні міститься 7 електронів, до завершення рівня бракує одного електрона, тому молекули складаються з двох атомів.
Вправа 9. Користуючись таблицею 2, наведіть приклади конкретних реакцій, складіть їхні рівняння.
Основний оксид + кислотний оксид = сіль
CaO + CO2 = CaCO3
Основний оксид + амфотерний оксид = сіль
Na2O + ZnO = Na2ZnO2
Основний оксид + кислота = сіль + вода
CuO + 2HCl = CuCl2 + H2O
Основний оксид + амфотерний гідроксид = сіль + вода
Na2O + Zn(OH)2 = Na2ZnO2 + H2O
Кислотний оксид + амфотерний оксид = сіль
CO2 + ZnO = ZnCO3
Кислотний оксид + основа = сіль + вода
CO2 + 2KOH = K2CO3 + H2O
Амфотерний оксид + кислота = сіль + вода
ZnO + 2HCl = ZnCl2 + H2O
Амфотерний оксид + основа = сіль + вода
ZnO + 2NaOH = Na2ZnO2 + H2O
Кислота + основа = сіль + вода
2HCl + Cu(OH)2↓= CuCl2 + 2H2O
Кислота + амфотерний гідроксид = сіль + вода
2HCl + Zn(OH)2 = ZnCl2 + 2H2O
Кислота + сіль = сіль + кислота
2HCl + Na2CO3= 2NaCl + CO2↑ + H2O
Основа + амфотерний гідроксид = сіль + вода
2NaOH + Zn(OH)2 = Na2ZnO2 + 2H2O
Основа + сіль = сіль + основа
Ba(OH)2 + Na2SO4 = BaSO4↓ + 2NaOH
Сіль + сіль = сіль + сіль
CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl