![]()
Сторінка 29
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Поясніть будову молекули води. У молекулі води атом Оксигену має чотири електронні пари. Дві з них беруть участь в утворенні ковалентних зв'язків з атомами Гідрогену. Ковалентний зв'язок утворюється за рахунок двох неспарених р-електронів атома Оксигену, що містяться на окремих двох р-орбіталях, та s-електронів атомів Гідрогену: р-орбіталі розташовані під кутом 900, ядра атомів Гідрогену позитивно заряджені (однойменно), тому частково відштовхуються і кут збільшується до 104,50. Молекула води має кутову будову.
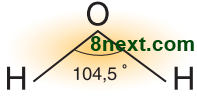
Дві пари електронів усуспільнені між атомами Гідрогену й атомом Оксигену, а дві пари неподілених електронів орієнтовані по інший бік Оксигену. За такої будови частина молекули, в якій зосереджено атоми Гідрогену, одержує частковий позитивний заряд і називається позитивним полюсом молекули, а частина молекули, в якій розташований атом Оксигену, одержує частковий негативний заряд і називається негативним полюсом молекули. Отже, молекула води — диполь.
Якщо молекула має два полюси, то її називають диполь («ди» — два, «поль» — полюс, тобто два полюси: + і –) і говорять, що вона полярна.
2. Схарактеризуйте водневий зв’язок. Сильнополярні молекули притягуються одна до одної завдяки електростатичному притяганні атомів Гідрогену і електронегативного атома (наприклад, Оксигену, Флуору тощо) різних молекул.
Чим менший розмір і більша електронегативність атома елемента, сполученого з Гідрогеном, то водневий зв’язок міцніший.
3. Обчисліть об’єм водню (н. у.), що вивільнюється внаслідок взаємодії з водою натрію кількістю речовини 0,5 моль.
Відомо: ν(Na)=0,5 моль. Знайти V(H2)-?
Розв'язування:
І спосіб
Записуємо рівняння реакції.
0,5 моль х л
2Na + 2H2O = 2NaOH + H2↑
2 моль 22,4 л
Над формулами речовин записуємо дані, що є за умовою задачі.
Мольні співвідношення речовин показують коефіцієнти рівняння. Прореагувало 2 моль натрію Na з утворенням 1 моль водню Н2 (1 моль газу за н.у. займає об'єм 22,4 л).
Відповідні значення записуємо під формулами речовин у рівнянні реакції.
Складаємо пропорцію і розв'язуємо її.
0,5 моль /2 моль = х л / 22,4 л, звідси
х л • 2 моль = 0,5 моль • 22,4 л
х=0,5 моль • 22,4 л / 2 моль
х=5,6 л.
ІІ спосіб
Записуємо рівняння реакції: 2Na+2H2O=2NaOH+H2↑
Мольні співвідношення речовин показують коефіцієнти рівняння.
Прореагувало 2 моль натрію Na з утворенням 1 моль водню Н2, кількість речовини водню у 2 рази менша, ніж кількість речовини натрію. Отже, якщо в реакцію вступає 0,5 моль натрію, то утворюється водень кількістю речовини у 3 рази меншою, тому
v(Н2)=v(Na):2=0,5 моль:2 =0,25 моль.
Знаходимо об'єм водню за формулою V=v•VM, де VM-постійна величина і за н.у. чисельно дорівнює 22,4 л/моль.
V(Н2)=v(Н2)•VM=0,25 моль•22,4 л/моль=5,6 л.
Відповідь: V(Н2)=5,6 л.
Додаткові завдання
Вправа 4. На вашу думку, чому випаровування води — процес, що супроводжується поглинанням теплоти? Молекули води притягуються одна до одної внаслідок електростатичного притягання атомів H і O різних молекул, тобто, завдяки взаємодії, яку називають водневим зв'язком. З підвищенням температури водневий зв’язок легко розривається. Цим пояснюється перехід води із твердого стану в рідкий і згодом — у газоподібний. Розрив хімічних зв'язків супроводжується поглинанням енергії.
Вправа 5. Між молекулами води й хлороводню можливий зв’язок типу:
G- G+
Н—О ··· Н—Cl
|
Н
Яким чином утворюється такий зв’язок і як він називається? Сильнополярні молекули притягуються одна до одної завдяки електростатичному притяганні атомів Гідрогену і електронегативного атома Оксигену різних молекул. Такий зв'язок називається водневим. Чому в результаті розчинення НCl у воді виділяється теплота? Хлороводень - газ, а при розчиненні газів у воді відсутня стадія руйнування кристалічних ґраток, тому виділяється теплота.
Вправа 6. З водою масою 36 г прореагував оксид металічного елемента зі ступенем окиснення +2 масою 310 г (правильно 306 г). Обчисліть кількість речовини гідроксиду металічного елемента, що утворився при цьому, і назвіть його.
Відомо: m(EО)=306 г, m(H2O)=36 г.
Знайти: v(E(OH)2)-?, елемент Е -?
Розв'язування:
І спосіб
Записуємо рівняння реакції оксиду з водою.
306 г 36 г у моль
ЕО + H2O = Е(ОН)2
х г 18 г 1 моль
Над формулами речовин записуємо дані, що є за умовою задачі.
Мольні співвідношення речовин показують коефіцієнти рівняння.
Прореагувало 1 моль оксиду ЕО і 1 моль води Н2О з утворенням 1 моль гідроксиду E(OH)2. Знаходимо молярну масу води, й відповідно, масу 1 моль.
Mr(H2O)=2•Ar(H)+Ar(O)=2•16+1=18 г/моль, тому маса 1 моль=18 г.
Позначимо молярну масу оксиду через х, тоді маса 1 моль=х г.
Відповідні значення записуємо під формулами речовин у рівнянні реакції.
Складаємо дві пропорції і розв'язуємо їх.
Пропорція для обчислення кількості речовини гідроксиду.
36 г / 18 г = у моль / 1 моль, звідси
у моль • 18 г = 36 г • 1 моль
у = 36 г • 1 моль / 18 г
х = 2 моль.
Пропорція для обчислення молярної маси оксиду.
306 г / х г = 36 г / 18 г, звідси
х г • 36 г = 18 г • 306 л
х = 18 г • 306 г / 36 г
х = 153 г.
Отже, молярна маса оксиду M(EО)=153 г/моль, тому Mr(EO)=153
Mr(EO)=Ar(E)+Ar(O), звідси Ar(E)=Mr(EO)-Ar(O)=153-16=137. Таку молекулярну масу має лужноземельний метал - Барій.
ІІ спосіб
Записуємо рівняння реакції оксиду з водою: ЕО+H2O=Е(ОН)2
Обчислюємо кількість речовини води масою 306 г за формулою y=m/M, де M=Mr г/моль.
Mr(H2O)=2•Ar(H)+Ar(O)=2•16+1=18 г/моль
v(Н2О)=m(Н2):M(H2O)=36 г : 18 г/моль=2 моль.
Мольні співвідношення речовин показують коефіцієнти рівняння.
Прореагувало 1 моль оксиду ЕО і 1 моль води Н2О з утворенням 1 моль гідроксиду E(OH)2, кількості речовин однакові, тому
v(Е(ОН)2)=v(EO)=v(Н2О)=2 моль
З формули v=m/M знаходимо молярну масу M=m/v.
M(EO)=m(EO)/v(EO)=306 г : 2 моль =153 г/моль, тому Mr(EO)=153
Mr(EO)=Ar(E)+Ar(O), звідси Ar(E)=Mr(EO)-Ar(O)=153-16=137. Таку молекулярну масу має лужноземельний метал - Барій.
Відповідь: v(Ba(ОН)2)=2 моль, Барій.