Вправа 13. Дайте визначення відомим вам типам хімічного зв’язку. Хімічний зв’язок, що виникає в результаті утворення спільних електронних пар, називають ковалентним. Хімічний зв’язок, що виникає в результаті притягання протилежно заряджених йонів, називають йонним.
Наведіть приклади речовин з різними типами хімічного зв’язку. Водень Н2, озон О3, хлор Сl2, фосфін РН3, хлороводень HCl, вода H2O, амоніак NH3, магній оксид MgO, натрій гідроксид NaOН, калій сульфат K2SO4.
Вправа 14. Який ковалентний зв’язок називають неполярним? полярним? Ковалентний зв’язок, при якому спільна електронна пара однаково притягується до двох атомів і належить їм обом в однаковій мірі, називається неполярним. Ковалентний зв’язок, при якому спільна електронна пара зміщується до атома з більшою електронегативністю, називається полярним.
Наведіть приклади сполук.
З ковалентним полярним зв'язком: хлороводень HCl, вода H2O, амоніак NH3.
З йонним типом зв'язку: характерний для основних оксидів (Na2O, MgO), лугів (NaOH, KOH) та солей (NaСl, KNO3)
Вправа 15. Як за значеннями електронегативності елементів, що містяться у складі речовин, можна відрізнити речовини з йонним зв’язком від речовин з ковалентним полярним зв’язком? У речовин з йонним зв'язком різниця електронегативностей елементів (ΔEH) ΔEH>2, а у речовин з ковалентним полярним - перебуває у межах 0,4<ΔEH≤2.
Вправа 16. Сформулюйте дві відмінності йонного зв’язку від ковалентного. Йонний зв'язок утворюється передачею електронів більш електронегативному атому, а ковалентний - утворенням спільних електронних пар, які зв'язують ядра атомів. У речовинах з йонним зв'язком, на відміну від ковалентного, атоми жорстко не з'єднуються один з одним, а просто притягуються один до одного електростатичними взаємодіями.
Вправа 17. Чим відрізняються кристалічні речовини від аморфних? Аморфні речовини, на відміну від кристалічних речовин, не мають постійної температури плавлення, а плавляться в широкому інтервалі температур і за внутрішньою будовою нагадують рідини, але не можуть текти; у розплавленому стані ім можна надати довільної форми.
Кристалічні речовини:
• структурні одиниці розташовані в чіткому порядку
• мають певну температуру плавлення
• утворюють кристали певної форми
Аморфні речовини:
• структурні одиниці розташовані хаотично
• плавляться в інтервалі температур
• під час нагрівання розм’якшуються
Наведіть приклади кристалічних і аморфних речовин.
Кристалічні: кухонна сіль, йод, лід, кремній, алмаз;
аморфні: скло, бурштин, смоли, застиглі лаки, фарби та клеї.
Вправа 18. Перелічіть фізичні властивості, що характерні для речовин з кристалічними ґратками:
а) йонними; Тверді, крихкі, мають високі температури плавлення і кипіння, нелеткі, тому не мають запаху, у твердому стані не проводять електричний струм, а в розплавах і розчинах проводять, більшість розчиняються у воді.
б) молекулярними; Мають невелику твердість, а звичайних умов перебувають у рідкому або газоподібному станах, крихкі, мають невисокі температури плавлення і кипіння, деякі з них сублімують (переходять з твердого стану у газоподібний, минаючи рідкий), леткі, тому мають запах, у твердому стані не проводять електричний струм, а розчини деяких з них проводять, розчиняються у воді або в інших розчинниках.
в) атомними. Надзвичайно тверді, не крихкі, мають дуже високі температури плавлення і кипіння, нелеткі, тому не мають запаху, не пластичні, більшість не проводять електричного струму, деякі є провідниками (графіт) або напівпровідниками (германій), не розчиняються у воді і в жодному розчиннику.
Вправа 19. Назвіть тип хімічного зв’язку в речовинах з кристалічними ґратками:
а) атомними; Ковалентний (полярний і неполярний)
б) йонними; Йонний
в) молекулярними. Ковалентний (полярний і неполярний) у молекулах та слабка взаємодія між молекулами
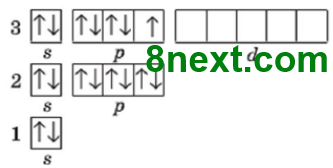
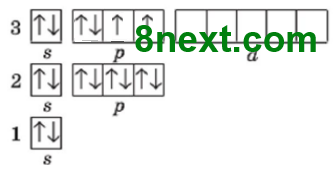
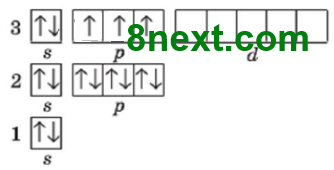
Вправа 20. Скільки електронних пар і неспарених електронів на зовнішньому енергетичному рівні атомів:
| а) Хлор | б) Сульфур | в) Фосфор |
|
Електронних пар:3 Неспарених електронів:1 |
Електронних пар:2 Неспарених електронів:2 |
Електронних пар:1 Неспарених електронів:3 |
Вправа 21. Назвіть по дві хімічні сполуки, в яких атоми Оксигену утворюють зв’язок:
а) йонний; Калій оксид K2О, натрій оксид Na2O.
б) ковалентний. Карбон (IV) оксид СО2, сульфур (IV) оксид SО2.
Ковалентний зв'язок виникає між атомами неметалічних елементів, а йонний - між атомами елементів, що суттєво відрізняються електронегативністю, тобто між типовими металічними і неметалічними елементами.
Вправа 22. Складіть електронні формули для молекул гідроген хлориду HCl, гідроген сульфіду H2S та амоніаку NH3. Скільки спільних і неподілених електронних пар містять атоми в кожній речовині?
|
гідроген хлориду HCl |
гідроген сульфіду H2S |
амоніаку NH3 |
|
.. H:Cl: .. 1 спільна, з неподілених |
.. H:S:H .. 2 спільних, 2 неподілених |
.. H:N:H .. H 3 спільних, 1 неподілена |
Електронну пару, яка не бере участі в утворенні хімічного зв’язку, називають неподіленою.
Вправа 23. Зобразіть схему утворення речовин з йонним зв’язком на прикладі калій флуориду.
|
.. .. K. + :F: -> [K+][:F:-] .. .. |
Вправа 24. Із наведеного переліку сполук H2, HBr, Na2O, CaO, CO2, CO, O2, NO2, K3N, NH3, N2, NF3, F2, OF2, MgF2 випишіть окремо сполуки, в яких хімічний зв’язок:
|
а) ковалентний неполярний |
б) ковалентний полярний |
в) йонний |
|
H2, O2, N2, F2 |
HBr, CO2, CO, NO2, NH3, NF3, OF2 |
Na2O, CaO, K3N, MgF2 |
Ковалентний неполярний зв'язок виникає між атомами однакових неметалічних елементів, а ковалентний полярний - між атомами різних неметалічних елементів. Йонний зв'язок виникає між атомами елементів, що суттєво відрізняються електронегативністю, тобто між типовими металічними і неметалічними елементами.
Вправа 25. Із наведеного переліку речовин CaBr2, O2, CuO, Вr2, C (алмаз), NaNO3, HCl, Fe2(SO4)3, CO2, H2O випишіть окремо речовини, що у твердому агрегатному стані мають кристалічні ґратки:
| а) атомні | б) йонні | в) молекулярні |
| C (алмаз) |
CaBr2, CuO, NaNO3, Fe2(SO4)3 |
O2, Вr2, HCl, CO2, H2O |
Вправа 26. Карборунд (силіцій карбід SiС) має температуру плавлення 2830 °С і за твердістю близький до алмазу. Який тип його кристалічних ґраток? Атомні кристалічні ґратки.
Вправа 27. Ванілін — безбарвна кристалічна речовина з приємним запахом. Які кристалічні ґратки він має? Молекулярні кристалічні ґратки.
Вправа 28. Певна безбарвна речовина добре розчиняється у воді й має високу температуру кипіння. Висловіть припущення щодо типу її кристалічних ґраток. Такі властивості мають речовини з йонними кристалічними ґратками.
Чи має ця речовина запах? Ні, не має.
Речовини з йонними кристалічними ґратками не є леткими, тому не мають запаху.