Вправа 223. Сформулюйте визначення швидкості реакції, каталізатора, інгібітора.
Швидкість хімічної реакції v — це фізична величина, що дорівнює відношенню зміни кількості утвореної або витраченої речовини ∆n до проміжку часу ∆t:
v = Δn(продукту)/Δt або v=- Δn(реагенту)/Δt
Іншими словами: швидкість реакції - це швидкість утворення її продуктів або витрачання реагентів.
Каталізатор — речовина, що бере участь у реакції та змінює її швидкість, але сама в реакції не витрачається.
Інгібіторами називаються каталізатори, які гальмують реакції.
Вправа 224. Від яких чинників залежить швидкість реакції? Поясніть, як саме впливають ці чинники на швидкість реакції.
Чинники, що впливають на швидкість реакції:
1. Природа реагентів (чим хімічно активніші речовини, тим швидше вони вступають у ті чи інші взаємодії).
2. Концентрація реагентів (чим більше частинок міститься в певному об’ємі, тим частіше вони зіштовхуються, тому більше частинок взаємодіють за одиницю часу). Для речовин у твердому агреатному стані поняття "концентрація" не використовують.
3. Ступінь подрібнення твердої речовини (у твердій речовині частинки не можуть вільно переміщуватися, вони лише коливаються, а реакція відбувається тільки на поверхні твердої речовини, тому чим дрібніша речовина, тим більша площа поверхні контакту, тому й вища швидкість реакції)
4. Температура (при нагріванні рідини або газу збільшується швидкість руху молекул, а при нагріванні твердої речовини - швидкість коливань частинок у ній й, відповідно, зростає кількість зіткнень частинок реагентів, тому переважна більшість реакцій за підвищенням температури відбувається швидше)
5. Наявність каталізатора (спеціальні речовини, що прискорюють реакції)
6. Тиск для реагентів-газів (у разі підвищення тиску збільшується концентрація газу, бо що більше стискають газову суміш, то менші відстані між її молекулами, тобто їх концентрація збільшується, частота зіткнень зростає й, відповідно, реакція відбувається швидше)
Наведіть приклади.
1. Лужні метали активно взаємодіють з водою (часто з вибухом), тоді як магній або кальцій з водою ледь реагують, а золото й срібло з нею взагалі не взаємодіють.
2. Горіння сірки, фосфору, заліза у повітрі відбуваються повільніше, ніж у чистому кисні.
3. Водень виділяється інтенсивніше при взаємодії кислоти з порошком цинку, ніж з гранулою. Алюмінієві вироби в повітрі не горять. Однак порошок алюмінію у разі внесення в полум’я загоряється, розкидаючи сніп іскор.
4. Виділення водню під час реакції кислоти з цинком відбувається швидше за нагрівання.
5. За звичайних умов реакція розкладу гідроген пероксиду відбувається дуже повільно, якщо додати каталізатор манган (ІV) оксид, реакція буде протікати дуже швидко.
Вправа 225. Прокоментуйте зміну концентрацій реагентів та продуктів реакції, а також зміст графіків за малюнком 20.1.
Під час хімічних реакцій концентрації реагентів зменшуються, а продуктів реакції — збільшується. За 60 хв протікання хімічної реакції число молекул (концентрація) реагентів зменшується від 50 до 0, а число молекул (концентрація) продуктів реакції — збільшується від 0 до 50.
Вправа 226. Чому продукти харчування зазвичай зберігають у холодильнику? За низької температури швидкість хімічних процесів зменшується. Охолодження уповільнює передчасне псування продуктів (розкладанання і гниття), тому харчові продукти зберігаються довше за низьких температур.
Вправа 227. Чому у формулі швидкості хімічної реакції зміна кількості речовини продуктів реакції є додатною величиною, а зміна кількості речовини реагентів — від’ємною? Оскільки під час хімічних реакцій концентрації продуктів реакції збільшуються
nпочаткове(продуктів)<nкінцеве(продуктів), а реагентів — зменшуються
nпочаткове(реагентів)>nкінцеве(реагентів), тому зміна кількості речовини продуктів реакції
∆n(продуктів)=nкінцеве(продуктів)-nпочаткове(продуктів)>0, а зміна кількості речовини реагентів
∆n(реагентів)=nкінцеве(реагентів)-nпочаткове(реагентів)<0.
Вправа 228. Поясніть, чому різноманітні хімічні реакції, що вимагають різних умов для їх перебігу, у живих організмах відбуваються з високою швидкістю за однакової температури й тиску. Хімічні реакції в живих організмах відбуваються за участі каталізаторів, які називають ферментами.
ферменти каталізують усі без винятку реакції в клітинах, причому для кожної біохімічної реакції існує свій фермент, а один фермент каталізує тільки одну конкретну реакцію.
Відповідь підтвердьте прикладами.
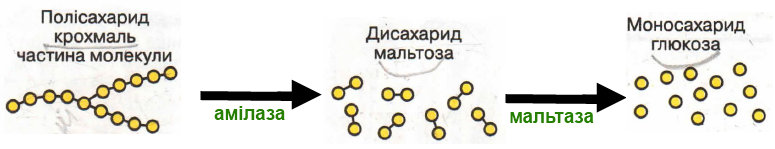
Вправа 229. Поясніть, чому існує небезпека вибуху за наявності великої кількості сухої горючої порошкоподібної речовини. Бо реакція окиснення відбувається дуже швидко в силу збільшення площі поверхні контакту реагентів, а теплота, що виділяється, спричиняє руйнування.
Наведіть приклади таких ситуацій. У кам’яновугільних шахтах у разі нагромадження вугільного пилу виникає загроза вибуху. Важко запалити шматок цукру, а цукровий пил може миттєво спалахнути й навіть вибухнути.
Завдання для засвоєння матеріалу
Вправа 230. Чи зміниться швидкість реакції між воднем та киснем, якщо до цієї суміші додати азот? Швидкість реакції зменшиться, бо зменшиться концентрація водню та кисню у загальному об'ємі новоутвореної суміші.
Вправа 231. Спираючись на знання про чинники впливу на швидкість хімічної реакції, обґрунтуйте твердження:
а) у багатті друзки згоряють набагато швидше, ніж ціле поліно такої самої маси;
Площа поверхні стикання друзків з киснем повітря є більшою й, відповідно, більшою є швидкість реакції горіння.
б) під час пожежі не можна відкривати вікна;
Бо зросте концентрація кисню, що надійде з повітрям через відчинене вікно, а кисень підтримує горіння.
в) у разі харчового отруєння часто призначають активоване вугілля, дія якого ефективніша, якщо пігулки максимально подрібнити;
Площа стикання подрібненого активованого вугілля є більшою у порівнянні з пігулками й, відповідно, швидкість реакції збільшиться.
г) щоб підвищити температуру полум’я, в багаття нагнітають повітря або чистий кисень;
Збільшують таким чином концентрацію кисню, а кисень підтримує горіння.
д) шинка за температури 180 °С приготується набагато швидше, ніж за 120 °С;
Зі збільшенням температури зростає швидкість хімічної реакції.
е) для стерилізації консервів або медичного обладнання їх певний час витримують за високої температури;
За високої температури відбувається денатурація білків, тобто руйнування структури і втрата біологічних функцій й, відповідно, загибель хвороботворних мікроорганізмів.
є) харчові продукти довше зберігаються у вакуумних пакетах;
З упаковки видаляють повітря, створюючи вакуум, таким чином уникають реакцій з речовинами довкілля: киснем, водою тощо.
ж) улітку підвищується небезпека харчових отруєнь;
Взаємодія речовин, що містяться у харчових продуктах, між собою і з речовинами довкілля - киснем, водою тощо - зі збільшенням температури зростає.
з) термін служби мідних водопровідних труб значно більший за залізні (сталеві).
Мідь є менш активнішим металом, ніж залізо, тому повільніше піддається корозії.
Вправа 232. За даними до малюнка 20.1 доведіть, що швидкість реакції максимальна в момент змішування речовин (на початку реакції) і з часом зменшується. Із наведеного графіка видно, що спочатку швидкість реакції найвища, бо концентрація реагентів є найбільша.
Як це можна пояснити? Це відбувається тому, що на початку реакції, коли концентрація реагентів найбільша, ймовірність зіткнення частинок речовин, що взаємодіють, найвища. У процесі реакції відбувається зменшення концентрації реагентів, а отже, знижується ймовірність зіткнення їх частинок.
Вправа 233. У дві колби налили хлоридну кислоту. У першу додали залізо кількістю речовини 0,01 моль, а в другу — цинк такої самої кількості. В якій колбі реакція закінчиться раніше? У колбі, що містить цинк, бо цинк активніший метал, ніж залізо.
Дивись ряд активності металів Бекетова.
Вправа 234. У кожній парі наведених процесів оберіть той, що має більшу швидкість (у кожному випадку поясніть свій вибір):
а) іржавіння заліза чи тьмяніння міді;
Залізо більш активніший метал, ніж мідь.
б) горіння воску чи горіння паперу;
Природа реагентів.
в) випарювання бензину чи випарювання води.
Різною є природа реагуючих речовин (у процесі реакції руйнуються хімічні зв’язки. Так, наявність водневих зв'язків між молекулами води є причиною високої температури кипіння води).
Вправа 235. На етикетці з морозивом ви прочитали інформацію про його строк придатності та умови зберігання, але деякі місця на етикетці були затерті: «### за температури мінус (24±2)°С, @@@ за температури мінус (18±2)°С». Ви звернулися по допомогу до продавця, на що отримали відповідь: «в одному місці там має бути написано “12 місяців”, а в іншому — “10 місяців”». Який надпис має стояти замість символів ###, а який — замість @@@? Замість символів ### має бути написано "12 місяців", а замість @@@ - "10 місяців".
Як ви вважаєте, як довго можна зберігати морозиво за температури +20 °С? Оскільки 12 місяців можна зберігати морозиво за температури -260C<t0С<-220C і 10 місяців — за температури -160C<t0С<-200C, то очевидним є те, що за температури +200С морозиво зберігати не можна.
Вправа 236. Було проведено два досліди з добування кисню нагріванням калій перманганату. У першому досліді отримали 75 мл кисню за 3 хв, а в другому — 100 мл за 5 хв. У якому випадку швидкість реакції вища?
Відомо: V1=75 мл, t1=3 хв, V2=100 мл, t2=5 хв.
Знайти: порівняти швидкості v1 i v2?
Розв'язування:
Оскільки кількість речовини прямо пропорційна об'єму, тому зміну об'єму також можна використовувати для оцінювання швидкості замість зміни кількості речовини, тому v=V/t.
v1=V1/t1=75 мл : 3 хв = 25 мл/хв
v2=V2/t2=100 мл : 5 хв = 20 мл/хв
25 мл/хв > 20мл/хв, тому v1>v2
Відповідь: у першому досліді швидкість реакції вища.
Вправа 237. За місяць до початку занять лаборант приготував водний розчин гідроген пероксиду, в 1 л якого містилося 0,3 моль H2O2. Першого вересня вчителька хімії визначила, що кількість гідроген пероксиду в колбі зменшилася вдвічі. Обчисліть швидкість розкладання гідроген пероксиду (моль/добу), уважаючи, що в місяці 30 днів. Який об’єм кисню(н.у.) виділився з 5 л розчину за цей час?
Відомо: V1(розчину)=1 л, n1(H2O2)=0,3 моль
Розв'язування:
За умовою задачі кількість речовини гідроген пероксиду зменшилася удвічі, тому n2(H2O2)=n1(H2O2)/2=0,3:2=0,15 моль
Швидкість розкладання гідроген пероксиду обчислюємо за формулою:
v=Δn/t=(0,3 моль - 0,15 моль):30 днів=0,005 моль/днів.
Записуємо рівняння реакції розкладання гідроген пероксиду:
2H2O2 = 2H2O + O2↑
Співвідношення кількості реагентів (у молях) дорівнює співвідношенню відповідних коефіцієнтів у рівнянні реакції.
За рівнянням записуємо співвідношення кількостей речовини:
n(H2O2)/2=n(О2) За цими співвідношеннями можна одразу обчислити об'єм, знаючи, що n=V/VM, де VM - постійна величина і за н.у. чисельно дорівнює 22,4 л/моль. У співвідношенні n(H2O2)/2=n(О2) замінюємо кількість речовини кисню на об'єм:
n(H2O2)/2=V(О2)/VM
Звідси виражаємо об'єм кисню:
V(О2)•2=VM•n(H2O2), тому
V(О2)=VM•n(H2O2):2=22,4 л/моль•0,3 моль : 2=3,36 л.
З 5 літрів розчину виділився у 5 разів більший об'єм кисню, тобто
V(О2)=3,36 л•5 =16,8 л.
Відповідь: 0,005 моль/днів, 16,8 л.
Вправа 238. У першій колбі відбувалася реакція між кальцій карбонатом та хлоридною кислотою, у результаті якої за певний час виділився газ масою 6,6 г. У другій колбі взаємодіяли водень та йод і за такий самий проміжок часу утворився продукт реакції масою 16,64 г. У якому випадку реакція відбувалася швидше?
СаСO3 + 2HCl = CaCl2 + H2O + CO2↑
H2 + I2 = 2HI
Відомо: m(CO2)=6,6 г, m(HI)=16,64 г
Знайти: де реакція відбулася швидше?
Розв'язування:
Оскільки швидкість хімічної реакції дорівнює відношенню зміни кількості продуктів реакції до проміжку часу, а за умовою задачі проміжок часу реакцій однаковий, тому достатньо порівняти кількості речовини продуктів реакції.
Кількість речовини обчислюємо за формулою n=m/M, де М=Mr г/моль
Mr(CO2)=Ar(C)+2•Ar(O)=12+2•16=44, тому М(СО2)=44 г/моль.
n(СО2)=m(СО2)/M(СО2)=6,6 г : 44 г/моль = 0,15 моль.
Mr(HI)=Ar(H)+Ar(I)=1+127=128, тому М(HI)=128 г/моль.
n(HI)=m(HI)/M(HI)=16,64 г : 128 г/моль = 0,13 моль.
n(СО2)>n(HI), тобто, за такий самий проміжок часу утворилася більша кількість речовини вуглекислого газу, тому в першому випадку швидкість реакції вища.
Відповідь: у першому випадку.
Вправа 239. Змішали карбон (ІІ) оксид кількістю 0,15 моль з киснем. Через 10 секунд після початку реакції кількість чадного газу зменшилася до 0,1 моль. Обчисліть швидкість цієї реакції.
Відомо: nпочаткове(CO)=0,15 моль, ∆t=10 с, nкінцеве(CO)=0,1 моль.
Знайти: v-?
Розв'язування:
Швидкість реакції обчислюємо за формулою v=∆n/∆t, ∆n=nпочаткове-nкінцеве
v=(nпочаткове(CO)-nкінцеве(CO))/∆t=(0,15 моль - 0,1 моль):10 c = 0,005 моль/c
Відповідь: 0,005 моль/с.
Вправа 240. Як ви вважаєте, за яким принципом обирають речовини (реагент або продукт реакції) для експериментального визначення швидкості хімічної реакції.
— обирають реагенти, що активно реагують один з одним;
— можливістю спостереження ознак хімічних реакцій під час експерименту;
— можливістю зробити вимірювання реагентів або продуктів реакції.
Опишіть методику експерименту та (за необхідності) прилад для визначення швидкості хімічної реакції:
а) цинку з хлоридною кислотою;
І спосіб (швидкість реакції - це швидкість утворення її продуктів)
У досліді використовується прилад для збирання газу методом витіснення води, бо водень погано розчиняється у воді.
За допомогою секундоміра фіксують час заповнення пробірки воднем.
За градацією пробірки визначають об'єм виділеного водню.
Оскільки кількість речовини прямо пропорційна об'єму (за н.у.), тому зміну об'єму також можна використовувати для оцінювання швидкості замість зміни кількості речовини.
ІІ спосіб (швидкість реакції - це швидкість витрачання реагентів)
Зважують цинк.
За допомогою секундоміра фіксують час візуального зменшенням шматка цинку під час реакції.
Обчислюють кількості речовини.
За формулою розраховують швидкість реакції.
б) горіння сірки в повітрі. (швидкість реакції - це швидкість витрачання реагентів)
Реакція горіння сірки в повітрі супроводжується появою блакитного полум'я і задушливим запахом палених сірників, тому дослід проводять у витяжній шафі.
Зважують сірку.
За допомогою секундоміра фіксують час реакції від початку горіння до зникнення грудки сірки.
Обчислюють кількості речовини.
За формулою розраховують швидкість реакції.
Вправа 241. Наведіть приклади хімічних процесів, що: а) бажано прискорювати; б) бажано уповільнювати; в) підтримувати швидкість на певному рівні. У який спосіб у кожному випадку можна контролювати або змінювати швидкість реакції?
а) бажано прискорювати;
Реакцію горіння при приготуванні їжі (дотримуватися допустимих меж температури).
б) бажано уповільнювати;
Іржавіння заліза (зменшити надмірну вологість), псування харчових продуктів (знизити температуру середовища - зберігати в охолодженому або замороженому стані, зменшити поверхню контакту речовин - загортання в папір, брикетувати, ізолювати від дії довкілля - вакуумна упаковка).
в) підтримувати швидкість на певному рівні.
Хімічні реакції у гальванічних елементах: батарейках і акумуляторах (використання за оптимальних температур).
Вправа 242*.Запропонуйте план експерименту для визначення швидкості хімічної реакції. Які вимірювання ви маєте зробити для досягнення мети? Оскільки швидкість реакції — це швидкість утворення її продуктів або витрачання реагентів, тому доцільно зафіксувати час реакції, спостерігаючи за фізичними ознаками протікання реакції (зміна кольору, поява чи розчинення осаду, виділення газу тощо), а також виміряти масу або об'єм реагентів чи продуктів реакції.
Які чинники впливатимуть на точність експерименту? Інстументальна похибка приладів, наприклад, терезів, неодночасність включення секундоміра та початку реакції чи виключення секундоміра по закінченню реакції, так званий, людський фактор тощо).
Вправа 243*.Згадайте з курсу фізики, що означає поняття «швидкість руху». Знайдіть спільні й відмінні ознаки у поняттях «швидкість руху тіла» та «швидкість хімічної реакції».
Спільні ознаки:
Швидкість є відношенням певної величини (відстані чи концентрації) до проміжку часу: моль/с, моль/л•с, м/с, км/год тощо.
Відмінні ознаки:
Швидкість характеризує рух фізичного тіла, а швидкість хімічної реакції — взаємодію частинок (йонів, молекул) речовин.
Фізичним тілом називають усе, що має розмір і форму, а речовина — це те, з чого складається фізичне тіло.