Вправа 334. Назвіть основні природні джерела вуглеводнів. Нафта, природний газ і кам’яне вугілля.
Вправа 335. На чому ґрунтується фізичний метод розділення нафти на фракції? Нафту розділяють на простіші суміші вуглеводнів — фракції — шляхом перегонки (дистиляції або ректифікації), яка ґрунтується на тому, що різні речовини у складі нафти киплять за різних температур.
У перекладі з латинської distille означає «крапля» і перегонка отримала назву "дистиляція". Суть перегонки нафти полягає в тому, що за різних температур окремі вуглеводні випаровуються, а під час охолодження знову набувають рідкого стану.
Вправа 336. На які фракції розділяють нафту під час перегонки? Схарактеризуйте їх застосування:
| Фракція | Застосування |
| Газова фракція | пальне |
| Бензин | автомобільне пальне |
| Лігроїн |
паливо, сировина для синтезу |
| Гас | авіаційний бензин |
| Газойль | дизельне пальне |
| Важкий газойль (мазут) | паливо для теплоелектростанцій |
| Важкий мазут |
виробництво асфальту, бітуму, парафіну, мастильних матеріалів, паливо для котелень |
Який продукт переробки нафти є найціннішим для сучасного суспільства? Бензин.
Вправа 337. Чим різняться найважливіші нафтопродукти за хімічним складом? Числом атомів Карбону в молекулах. Наприклад, газова фракція містить число атомів Карбону в молекулі від 1 до 4, бензин - від 5 до 10, лігроїн - від 6 до 12, гас - від 10 до 16, газойль - від 13 до 25, мазут - від 26 до 30, важкий мазут - понвд 30.
Вправа 338. Використовуючи інформацію цього та попередніх параграфів, опишіть використання природного газу в хімічній промисловості. Природний газ є цінною сировиною для виробництва багатьох органічних і неорганічних речовин, наприклад, ацетилену, етену, синтетичного бензину, сажі, водню та багатьох інших речовин.
Вправа 339. Які основні продукти добувають коксуванням кам’яного вугілля? Кокс (використовується як відновник у металургії, наприклад, для добування заліза з його оксидів)), і кам'яно-вугільна смола (використовується для одержання ароматичних сполук).
Вправа 340. Чому кам’яне вугілля під час переробки нагрівають без доступу повітря? Щоб не було горіння.
Вправа 341. Чому природний газ кращий за кам’яне вугілля як паливо? Бо природний газ є екологічно чистішим видом палива, оскільки під час його згоряння виділяються речовини, які є менш шкідливі, ніж ті, що утворюються при згорянні кам'яного вугілля. При згорянні кам'яного вугілля, негорючі домішки, що в ньому містяться, перетворюються на шлаки, а також утворюються оксиди, що забруднюють атмосферу, бо у складі вугілля є невеликі кількості сполук Сульфуру й Нітрогену.
Вправа 342. Які речовини та матеріали добувають переробкою кам’яного вугілля та природного газу?
Переробкою кам'яного вугілля отримують кокс, коксовий газ, кам'яно-вугільну смолу, амоніачну воду тощо.
Переробкою природного газу отримують ацетилен, етен, синтетичний бензин, сажу, водень тощо.
Вправа 343. Під час крекінгу вуглеводню C20H42 утворюються два продукти з однаковим числом атомів Карбону в молекулах. Складіть рівняння реакції.
Продукти крекінгу: вуглеводень -> алкан (CnH2n+2) + алкен (CnH2n)
С20H42 - > C10H22 + C10H20
Вправа 344. У чому полягає принципова відмінність крекінгу нафти від ректифікації? Ректифікація - це фізичний процес розділення однорідної суміші нафти на фракції (простіші суміші) з різною молекулярною масою. Крекінг нафти - це хімічний процес розкладу вуглеводнів нафти. Отже, під час ректифікації нафти хімічний склад компонентів не змінюється, а під час крекінгу речовини зазнають змін складу і будови.
Вправа 345. Як ви вважаєте, чому під час прямої перегонки нафти не вдається переробити її на бензин більш ніж 20%? Бо в однорідній суміші нафти, що складається із кількох сотень речовин, насичені вуглеводні із числом атомів Карбону в молекулі від 1 до 5 становлять 20%.
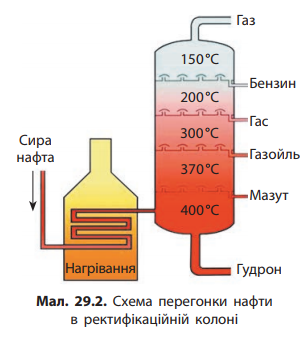
Вправа 346. Проаналізуйте мал. 29.2 і опишіть, як відбувається перегонка нафти. Сиру нафту спочатку нагрівають у спеціальній печі до 4000С, після чого її компоненти, що мають меншу температуру кипіння, переходять у газоподібний стан. Далі пари нафти спрямовують у ректифікаційну колону, яка являє собою вертикальний циліндр (заввишки 80 м і більше й до 8 м у діаметрі), усередині поділений спеціальними перегородками - тарілками з отворами (буває 30-40 тарілок в колонах). Над отворами встановлюються ковпачки, на яких і конденсуються (охолоджуються, тобто перетворюються на рідину) пари речовин, близьких між собою за температурою кипіння і густиною. Так утворюються певні нафтопродукти (бензин, гас, газойль тощо) для яких наявні в колоні свої секції і свої виходи.
Вправа 347. Складіть рівняння реакцій добування етилену та ацетилену з компонентів природного газу.
CH3-CH3 -> CH2=CH2 + H2↑ (при t0C, кат.)
2CH4 -> CH≡CH + 3H2↑ (при t0C)
Вправа 348. Один з компонентів бензину — це вуглеводень складу C8H18. Складіть рівняння реакції добування його з карбон (II) оксиду й водню.
8СO + 17H2 = C8H18 + 8H2O
Вправа 349. Під час повного згоряння бензину у двигунах утворюються вуглекислий газ і вода. Складіть рівняння реакції згоряння бензину, якщо вважати, що він складається з вуглеводню складу C8H18.
2C8H18 + 25O2 = 16CO2 + 18H2O
Вправа 350. У вихлопних газах автомобілів містяться отруйні речовини: карбон (II) оксид і нітроген (IV) оксид. Поясніть, у результаті яких хімічних реакцій вони утворилися. Карбон (ІІ) оксид (чадний газ) утворюється внаслідок неповного згоряння (при нестачі кисню) пального у двигунах, а нітроген (IV) оксид внаслідок згоряння нітрогеновмісних компонентів пального.
Вправа 351. Обчисліть, у скільки разів збільшиться об’єм паливно-повітряної суміші, що складається із 40 мл випарів октану і 3 л повітря, у разі її підпалювання. Під час обчислення вважайте, що в повітрі міститься 20% кисню (за об’ємом).
Відомо: V(C8H18)=40 мл, V(повітря)=3 л=3000 мл, φ(O2)=20% або 0,2.
Знайти: у скільки разів збільшиться об’єм паливно-повітряної суміші?
Розв'язування:
Знаходимо об'єм паливно-повітряної суміші до реакції:
V(C8H18,повітря)=40 мл + 3000 мл=3040 мл
Знаходимо об'єм кисню, що міститься в 3000 мл повітря:
V(O2)=φ(O2)•V(повітря)=0,2•3000 мл=600 мл
У паливно-повітряній суміші горить октан, тому запишемо рівняння реакції горіння октану:
2C8H18 + 25O2 -> 16CO2 + 18H2O
Обчислимо за законом Гей-Люссака об'єми О2, що вступив в реакцію, та СО2 і Н2О, що утворилися після реакції. За рівнянням реакції V(C8H18):V(O2):V(CO2):V(H2O)=2:25:16:18=1:12,5:8:9, тому
V(O2)=12,5•V(C8H18)=12,5•40 мл=500 мл
V(СO2)=8•V(C8H18)=8•40 мл=320 мл
V(Н2О)=9•V(C8H18)=9•40 мл=360 мл
Оскільки в реакцію вступило 40 мл октану і 500 мл кисню, то прореагувало 540 мл суміші, тоді 3040 мл-540 мл=2500 мл суміші залишилося.
Знаходимо об'єм продуктів реакції:
V(CO2,H2O,залишок суміші)=320 мл + 360 мл + 2500 мл=3180 мл
3180 мл : 3040 мл=1,046≈1,05 рази збільшиться об'єм паливно-повітряної суміші.
Відповідь: в 1,05 рази.
Вправа 352. Бензин, що продають у країнах з теплим кліматом, складається з вуглеводнів з більшою молекулярною масою, ніж бензин, що продають у країнах із холодним кліматом. Висловіть припущення, чому нафтопереробники варіюють бензин у такий спосіб. Вуглеводні з більшою молекулярною масою киплять й, відповідно, випаровуються за вищої температури, тому у країнах з холодним кліматом бензин містить вуглеводні з меншою молекулярною масою (леткі), що дозволяє здійснювати запуск навіть холодного двигуна.
Вправа 353*. Нафта містить стільки різних цінних органічних речовин, що Д. І. Менделєєв, який певний час досліджував нафту, говорив про неї: «Спалювати нафту в топці — це майже те саме, що топити асигнаціями».
Як ви розумієте цей вислів Д. І. Менделєєва? Асигнації - це гроші. Цими словами Д.І.Менделєєв говорив про те, що невигідно просто спалювати нафту, а краще її переробляти й одержувати з неї цінні продукти.
Вправа 354*. У додаткових джерелах знайдіть інформацію про матеріали й речовини, сировиною для яких є нафта, природний газ або кам’яне вугілля. Пластмаса, синтетичний каучук, синтетичні волокна, вибухові речовини, мийні засоби, фарби, ліки, лаки, вазелін, парафін, холодоагенти для холодильників, ароматичні речовини, синтетичний бензин, метиловий спирт, етанова (оцтова) кислота тощо. Чи можна їх виготовити без використання природних джерел вуглеводнів? Тільки деякі з них можна. Наприклад, етанову кислоту, каучук, волокна добувають з іншої природної сировини, але у невеликих обсягах і вона є більш дороговартісною. Природні джерела вуглеводнів є дешевою сировиною і запаси цих природних копалин наявні у великих обсягах. Чи можна сучасному людству відмовитися від використання цих матеріалів? Без цих речовин й матеріалів навіть важко уявити собі сучасне життя, причому більшість з них не існує в природі, а є продуктами хімічної промисловості.