Вправа 356. Які речовини відносять до класу спиртів? Похідні вуглеводнів, у молекулах яких один або кілька атомів Гідрогену заміщені на гідроксильну групу –OH.
Вправа 357. Яка група атомів наявна в молекулах спиртів? Гіідроксильна група –OH
Вправа 358. Як пов’язана назва спирту з назвою відповідного алкану? Назва спирту походить від назви алкану, в якій суфікс -ан замінюють на суфікс -ол.
Вправа 359. Схарактеризуйте фізичні властивості етанолу. Летка безбарвна рідина зі специфічним запахом, пекуча на смак, легша за воду (густина 0,789 г/см3), легко випаровується (tпл. = –114,2 °С, tкип.=78,4 °С), необмежено розчиняється у воді, а також добре змішуються з іншими органічними речовинами (бензеном, хлороформом, ацетоном тощо).
Поясніть вплив на них водневого зв’язку. Наявність водневим зв’язків між молекули спиртів є причиною вищої температури кипіння спиртів порівняно з відповідними вуглеводнями, бо для того, щоб перетворити спирт із рідини на газ, треба спочатку затратити енергію на розрив водневих зв’язків між молекулами, а потім — енергію, щоб перевести молекули спирту в газоподібний стан. Наявність водневих зв’язків між молекулами спирту і води є причиною того, що спирти у воді розчиняються дуже добре, а вуглеводні — ні.
Вправа 360. Запишіть рівняння реакції горіння етанолу.
C2H5OH + 3O2 -> 2CO2 + 3H2O
Вправа 361. Опишіть застосування етанолу. На яких властивостях воно ґрунтується?
- пальне у двигунах внутрішнього згорання (легкозаймиста речовина та екологічно чисте пальне);
- сировина в синтезі органічних речовин (бутадієну, етилену, оцтової кислоти, хлороформу тощо);
- складова парфумерних виробів (парфумів, одеколонів, лосьйонів, дезодорантів), лікарських препаратів, бальзамів, трав'яних настоянків, в харчовій промисловості (є добрим розчинником);
- компонент склоочисних рідин, антифризів (завдяки низькій температурі замерзання);
- складова знезаражувальних засобів (йоду, зеленки), консервування біологічних препаратів (є добрим антисептиком).
Вправа 362. Використовуючи структурні формули, доведіть, що метанол та етанол — насичені спирти.
Структурні формули метанолу, етанолу, гліцеролу.
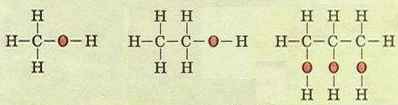
У молекулах цих сполук всі зв'язки одинарні, тобто всі валентності Карбону використані на сполучення з атомами Гідрогену й Оксигену, тому метанол та етанол - насичені спирти.
Вправа 363. Які фізичні властивості етанолу свідчать про його молекулярну будову? Летка рідина зі специфічним запахом, має низькі температури плавлення та кипіння.
Вправа 364. Розчини спиртів у воді не проводять електричний струм, тоді як розчини лугів, що також містять гідроксильну групу, проводять. Чим це можна пояснити? Під дією молекули води йонний зв'язок між Na+ i OH- руйнується і в розчин переходять гідратовані йони, які є носіями струму. При розчиненні спиртів ковалентний полярний зв'язок між вуглеводневим залишком і гідроксильною групою ОН не руйнується, тому етанол не виявляє основних властивостей.
Вправа 365. Етиловий спирт використовують для виготовлення парфумів. На якій властивості етанолу ґрунтується таке його застосування? Етанол є розчинником багатьох речовин.
Вправа 366. Використовуючи значення електронегативностей, порівняйте полярність зв’язків C–H, C–O і O–H. Значення електронегативності С(2,5), Н(2,1), О(3,5). Полярність ковалентного зв'язку залежить від різниці електронегативності атомів елементів. Чим більшою є ця різниця, тим більш полярним є зв'язок.
У зв'язку С-Н: 2,5 - 2,1=0,4;
у зв'язку С-О: 3,5 - 2,5=1;
У зв'язку О-Н: 3,5 - 2,1=1,4;
Отже, зв’язки С–Н в молекулах малополярні, а найбільш полярним є зв'язок О-Н.
Молекули яких речовин — спиртів чи вуглеводнів — більш полярні?
Молекули спиртів більш полярні, що зумовлює можливість утворення водневого зв’язку як між молекулами спиртів, так і між молекулами спиртів та молекулами води. Молекули вуглеводнів малополярні, тому водневі зв’язки між молекулами вуглеводнів (і між молекулами вуглеводнів і води) не утворюються. Як це позначається на фізичних властивостях цих речовин? Спирти розчиняються дуже добре у воді, а вуглеводні - ні. Спирти мають вищу температуру кипіння у порівнянні з вуглеводнями.
Вправа 367. Під час згоряння етанолу кількістю речовини 1 моль виділяється 1408 кДж теплоти. Складіть термохімічне рівняння цієї реакції.
C2H5OH + 3O2 -> 2CO2 + 3H2O; ΔН=-1408 кДж/моль.
Тепловий ефект (у нашому випадку - кількість теплоти, що виділяється) стосується тієї кількості моль, що показують коефіцієнти рівняння реакції.
Вправа 368. На етикетці лікарського препарату написано: «Склад: фенобарбітал 20 г, ізобутиловий ефір валеріанової кислоти 40 г, спирт етиловий 480 г, вода 520 г». Обчисліть масову частку етанолу в цьому препараті.
Відомо: m(фенобарбіталу)=20 г, m(ефіру)=40 г, m(C2H5OH)=480 г,
m(Н2О)=520 г. Знайти: w(C2H5OH)-?
Розв'язування:
Обчислюємо масу розчину лікарського препарату:
m(розчину)=m(фенобарбітал)+m(ефіру)+m(C2H5OH)+m(Н2О)=
= 20 г + 40 г + 480 г + 520 г = 1060 г
Обчислюємо масову частку етанолу за формулою w(речовини)=m(речовини)/m(розчину):
w(C2H5OH)=m(C2H5OH)/m(розчину)=480 г : 1060 г = 0,453, або,
помноживши це значення на 100%, одержимо 45,3%.
Відповідь: 45,3% або 0,453.
Вправа 369. Обчисліть масу етанолу, для згоряння якого вистачить кисню об’ємом 6,72 л (н. у.).
Відомо: V(O2)=6,72 л. Знайти: m(C2H5OH)-?
Розв'язування:
Виразимо об'єм С2H5OH через кількість речовини (n=V/VM, де VM - постійна величина і за н.у. чисельно дорівнює 22,4 л/моль)
n(C2H5OH)=V(C2H5OH)/VM=6,72 л : 22,4 л/моль = 0,3 моль
Записуємо рівняння реакції: C2H5OH + 3O2 -> 2CO2 + 3H2O
Співвідношення кількості реагентів (у молях) дорівнює співвідношенню відповідних коефіцієнтів у рівнянні реакції.
За співвідношенням кількості речовини етанолу і кисню n(C2H5OH)/1=n(O2)/3 обчислимо кількість речовини етанолу.
n(C2H5OH)=n(O2):3=0,3 моль:3=0,1 моль.
З формули n=m/M, де М=Mr г/моль, знаходимо масу m=n•M.
Mr(C2H5OH)=2•Ar(C)+6•Ar(H)+Ar(O)=2•12+6•1+16=46, тому
М(C2H5OH)=46 г/моль.
m(C2H5OH)=n(C2H5OH)•M(C2H5OH)=0,1 моль•46 г/моль=4,6 г
Відповідь: 4,6 г.
Вправа 370. Обчисліть об’єм кисню, необхідного для згоряння випарів етанолу об’ємом 3 л. Який об’єм вуглекислого газу при цьому утвориться?
Відомо: V(C2H5OH)=3 л. Знайти: V(O2)-?, V(CO2)-?
Розв'язування:
Записуємо рівняння реакції горіння етанолу:
С2H5OH + 3O2 -> 2CO2 + 3H2O
Для згоряння однієї молекули етанолу витрачається три молекули кисню, тому об’єми речовин співвідносяться як 1:3. Отже, для згоряння будь-якого об’єму етанолу витрачається кисню у 3 рази більше:
V(O2) =3•V(С2H2OH)=3•3 л = 9 л.
При згоряння однієї молекули етанолу утворюється дві молекули вуглекислого газу, тому об’єми речовин співвідносяться як 1:2. Отже, при згорянні будь-якого об’єму етанолу утворюється вуглекислого газу у 2 рази більше::
V(СO2)=2•V(C2H5OH)=2•3 л = 6 л.
Відповідь: V(O2)=9 л, V(СO2)=6 л.
Вправа 371. Спалили етиловий спирт масою 11,5 г. Вуглекислий газ, що утворився, пропустили крізь вапняну воду в склянці. Обчисліть масу утвореного осаду, якщо утворилася тільки середня сіль.
Відомо: m(C2H5OH)=11,5. Знайти: m(CaCO3)-?
Розв'язування:
Виразимо масу C2H5OH через кількість речовини (n=m/M, де М=Mrг/моль; Mr(С2H5OH)=2•Ar(C)+6•Ar(H)+Ar(O)=2•12+6•1+16=46, тому М(С2H5OH)=46 г/моль)
n(С2H5OH)=m(С2H5OH)/M(C2H5OH)=11,5 г : 46 г/моль=0,25 моль
Записуємо рівняння реакції: С2H5OH + 3О2 -> 2СO2 + 3H2O
Співвідношення кількості реагентів (у молях) дорівнює співвідношенню відповідних коефіцієнтів у рівнянні реакції.
За рівнянням записуємо співвідношення кількостi речовини етилового спирту і вуглекислого газу: n(С2Н5ОН):n(СО2)=1:2, кількість речовини вуглекислого газу удвічі більша кількості речовини етилового спирту, тому
n(СО2)=2•n(С2Н5ОН)=2•0,25 моль=0,5 моль.
Записуємо рівняння реакції: СО2 + Са(ОН)2 -> СаСO3↓ + H2O
За рівнянням записуємо співвідношення кількостi речовини куглекислого газу і кальцій карбонату: n(СО2):n(СаСО3)=1:1, кількості речовин однакові, тому n(СаСО3)=n(СО2)=0,5 моль
З формули n=m/M, де М=Mr г/моль, знаходимо масу m=n•M
Mr(СаСО3)=Ar(Ca)+Ar(C)+3•Ar(O)=40+12+3•16=100, тому
М(СаСО3)=100 г/моль
m(СаCO3)=n(СаCО3)•M(CaСO3)=0,5 моль•100 г/моль=50 г
Відповідь: m(CaCO3)=50 г.
Вправа 372*. У додаткових джерелах знайдіть інформацію про добування етанолу.
1) Етанол у природі утворюється під час спиртового бродіння глюкози за наявності грибів — дріжджів:
C6H12O6 -> 2C2H5OH + 2CO2↑
2) Гідратація етену:
CH2=CH2 + H2O -> C2H5OH