Вправа 390 Які речовини належать до карбонових кислот? Похідні вуглеводнів, у молекулах яких міститься карбоксильна група —COOH.
Вправа 391. Як утворюються назви карбонових кислот? Додаванням до назви вуглеводню закінчення -ова кислота.
Вправа 392. В які хімічні взаємодії вступають карбонові кислоти? Горять, змінюють колір індикаторів, реагують з активними металами, основними оксидами, лугами й солями.
Що спільного в хімічних властивостях етанової кислоти й неорганічних кислот? Змінює колір індикаторів, реагує з активними металами, основними оксидами, лугами й солями слабкіших кислот.
Вправа 393. Поясніть, чому етанова кислота є одноосновною. Із чотирьох атомів Гідрогену, які містяться в молекулі етанової кислоти CH3COOH, тільки один, що входить у карбоксильну групу –COOH, здатний відщеплюватися у вигляді катіона H+, тому етанова кислота одноосновна.
Вправа 394. Схарактеризуйте поширеність карбонових кислот у природі.
Вони містяться у складі багатьох овочів, фруктів та інших харчових продуктів:
- яблучна кислота (яблука, кавуни, горобина, малина, барбарис);
- мурашина кислота (залози мурах та бджіл, кропива, хвоя, жалкі медузи);
- лимонна кислота (хвоя, цитрусові, китайський лимонник);
- щавлева кислота (щавель, помідори, карамболь, ревінь);
- молочна кислота (кисломолочні продукти, накопичується в м’язах під час навантаження);
- винна кислота (виноградний сік, вино, кислий сік багатьох фруктів).
Вправа 395. Доведіть, що етанова кислота є насиченою сполукою. Етанова кислота не вступає в реакції приєднання за кратним зв'язком, що властиві ненасиченим сполукам.
Вправа 396. Перелічіть сфери застосування етанової кислоти. Для кожного прикладу поясніть, на яких властивостях ґрунтується її застосування.
Виготовлення кіноплівки (органічний розчинник)
Виготовлення засобів боротьби з комахами (подразнююча дія)
Виробництво ацетатного волокна (сировина)
Синтез лікарських препаратів (сировина)
Синтез фруктових есенцій (компонент естерів)
Синтез барвників для тканин (сировина)
Видалення вапняного накипу (здатність витісняти карбонатну кислоту з її нерозчинних солей)
Консервування продуктів (бактерицидна дія)
Приправа до їжі (смакові якості)
Вправа 397. Складіть схему утворення водневих зв’язків між:
а) двома молекулами етанової кислоти;
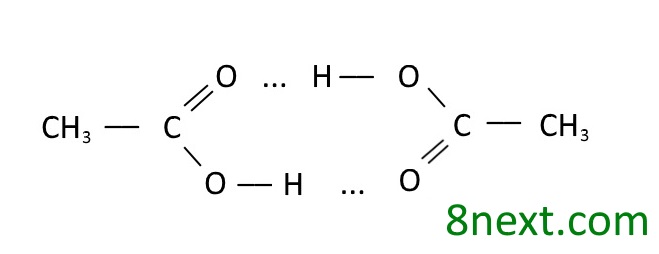
б) молекулою етанової кислоти та молекулами води.
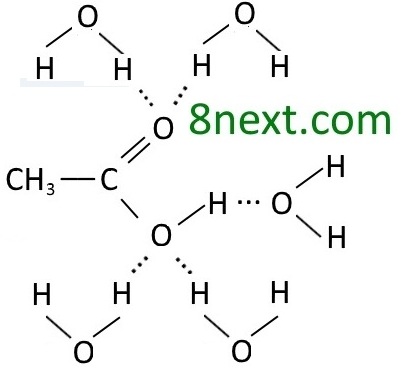
Поясніть вплив водневого зв’язку на фізичні властивості етанової кислоти:
- необмежено розчиняється у воді;
- за звичайних умов є рідиною;
- має високу температуру плавлення та кипіння порівняно з речовинами схожої будови, що не утворюють водневих зв'язків.
Вправа 398. Порівняйте хімічні властивості неорганічних і карбонових кислот. Для цього в одному стовпчику складіть рівняння реакцій хлоридної кислоти, а в другому стовпчику — етанової кислоти з: KOH, Mg, FeO, CaCO3.
Рівняння реакції хлоридної кислоти:
HCl +KOH = KCl + H2O
2HCl + Mg = MgCl2 + H2↑
2HCl + FeO = FeCl2 + H2O
2HCl + CaCO3 = CaCl2 + CO2↑ + H2O
Рівняння реакції хлоридної кислоти:
CH3COOH +KOH = CH3COOK + H2O
2CH3COOH + Mg = Mg(CH3COO)2 + H2↑
2CH3COOH + FeO = Fe(CH3COO)2 + H2O
2CH3COOH + CaCO3 = Ca(CH3COO)2 + CO2↑ + H2O
Вправа 399. Як відрізнити розчин оцтової кислоти від: а) розчину етанолу; б) хлоридної кислоти?
а) за запахом;
за зміною кольору індикатора (змінює оцтова кислота);
за здатністю витісняти вуглекислий газ з солей карбонатів (тільки в розчині оцтової кислоти появляться бульбашки газу).
2CH3COOH + Na2CO3 = 2NaCH3COO + CO2↑ + H2O
б) за запахом;
за реакцією з сіллю аргентум (І) хлоридом (у пробірці з хлоридною кислотою випадає сирнистий осад AgCl↓).
HCl + AgNO3 = AgCl↓ + HNO3
Вправа 400. Для видалення плям іржі з одягу їх можна обробити розчином етанової кислоти. Складіть молекулярне та йонно-молекулярне рівняння реакції, що при цьому відбувається, якщо іржу описати формулою ферум (III) гідроксиду.
3CH3COOH + Fe(OH)3↓ = Fe(CH3COO)3 + 3H2O
3CH3COO- + 3H+ + Fe(OH)3↓ = Fe3+ + 3CH3COO- + 3H2O
3H+ + Fe(OH)3↓ = Fe3+ + 3H2O
Вправа 401. Для маринування огірків вам потрібно 750 мл столового оцту (масова частка кислоти 6%, густина розчину дорівнює густині води), але у вас є тільки оцтова есенція (масова частка кислоти 70%). Обчисліть масу оцтової есенції та об’єм води, що до неї необхідно додати, для приготування необхідної вам кількості оцту.
Відомо: V(стол.оцту)=750 мл, ω0(СH3COOH)=6%, ωе(СH3COOH)=70%,
ρ(стол.оцту)=ρ(H2O)=1 г/мл.
Знайти: m(есенції)-?, V(H2O)-?
Розв'язування
1. Розраховуємо масу столового оцту за формулою m=V●ρ:
m(стол.оцту)=V(стол.оцту)•ρ(стол.оцту)=750 мл • 1 г/мл =750 г
2. Обчислюємо масу оцтової кислоти в столовому оцті:
m0(СH3COOH)=(ω0(СH3COOH)•m(стол.оцту)):100%=(6%•750 г):100%=45 г
3. Обчислюємо масу оцтової есенції:
m(есенції)=(m0(СH3COOH):ωе(СH3COOH))•100%=(45 г: 70%)•100%=64,3 г
4. Розраховуємо масу води, що треба долити до оцтової есенції, щоб отримати 750 мл столового оцту:
m(Н2О)=m(стол.оцту)-m(есенції)=750 г - 64,3 г = 685,7 г
5. Розраховуємо об'єм води за формулою V=m/ρ:
V(Н2О)=m(H2O):ρ(H2O)=685,7 г : 1 г/мл = 685,7 мл
Відповідь: необхідно до 64,3 г есенції додати 685,7 мл води.
Вправа 402. Натрій етаноат використовують як консервант для харчових продуктів. На харчовому комбінаті постало завдання приготувати 100 л розчину цієї солі з масовою часткою 0,05%, густина розчину дорівнює густині води. Обчисліть масу кристалогідрату натрій етаноату тригідрату, що вам знадобиться для цього.
Відомо: V(розчину)=100 л, ω(СH3COONa)=0,05%, ρ(розчину)=ρ(H2O)=1 кг/л.
Знайти: m(СH3COONa•3H2O)-?
Розв'язування
1. Розраховуємо масу розчину за формулою m=V●ρ:
m(розчину)=V(розчину)•ρ(розчину)=100 л • 1 кг/л =100 кг
2. Обчислюємо масу солі в розчині:
m0(СH3COONa)=(ω(СH3COONa)•m(розчину)):100%=(0,05%•100 кг):100%=
=0,05 кг
3. Обчислюємо молярну масу (M=Mr кг/кмоль) кристалогідрату:
M(СH3COONa•3H2O)=M(CH3COONa)+3•M(H2O)=82+3•18=136 кг/кмоль, де
Mr(СH3COONa)=Ar(Na)+2•Ar(C)+2•Ar(O)+3•Ar(H)=23+2•12+2•16+3•1=82,
Mr(H2O)=2•Ar(H)+Ar(O)=2•1+16=18
4. Розраховуємо масу кристалогідрату, що містить 0,05 кг безводної солі:
82 кг солі СH3COONa міститься в 136 кг кристалогідрату, тоді
0,05 кг солі СH3COONa - в х кг кристалогідрату.
0,05 кг / 82 кг = х кг / 136 кг
х кг●0,82 кг / 0,05 кг●136 кг
х = 0,05 кг • 136 кг : 0,82 кг
х = 0,0829 кг=82,9 г.
Відповідь: 82,9 г кристалогідрату СH3COONa•3H2O .
Вправа 403. Сіль Плюмбуму й оцтової кислоти — плюмбум (II) етаноат — широко застосовують у медицині для свинцевих примочок. Ця сіль солодка на смак, тому її називають також свинцевим цукром, але завдяки йонам Плюмбуму вона надзвичайно отруйна. Складіть рівняння реакції добування свинцевого цукру взаємодією металу з кислотою. Обчисліть масу цієї солі, що можна добути зі свинцю масою 1 г.
Відомо: m(Pb)=1 г. Знайти: m((CH3COO)2Pb)-?
Розв'язування
1. Виразимо масу Pb через кількість речовини (n=m/M, де М=Mrг/моль;
Mr(Pb)=Ar(Pb)=207, тому М(P)=207 г/моль)
n(Pb)=m(Pb)/M(Pb)=1 г : 207 г/моль=0,00483 моль
2. Записуємо рівняння реакції: Pb+2СH3COOH -> (CH3COO)2Pb + H2↑
За рівнянням реакції записуємо співвідношення кількостi речовини плюмбуму і плюмбум (IIІ) етаноату: n(Pb):n((CH3COO)2Pb)=1:1, кількості речовини однакові, тому
n((CH3COO)2Pb)=n(Pb)=0,00483 моль
3. Масу солі кількістю речовини 0,00483 моль обчислюємо за формулою m=n•M, де
М=Mr г/моль
Mr((СH3COO)2Pb)=Ar(Pb)+4•Ar(C)+6•Ar(H)+4•Ar(O)=207+4•12+6•1+4•16=325,
тому М((CH3COO)2Pb)=325 г/моль
m(СH3COO)2Pb)=n(СH3COO)2Pb)•M(СH3COO)2Pb)=0,00483 моль•325 г/моль=
=1,57 г
Відповідь: 1,57 г.
Вправа 404. Ферум (II) етаноат використовують для обробки залізних поверхонь для запобігання корозії. Добути його можна взаємодією металу з кислотою. Обчисліть масу заліза, необхідного для добування цієї солі масою 26,1 г.
Відомо: m((CH3COO)2Fe)=26,1 г. Знайти: m(Fe)-?
Розв'язування
1. Виразимо масу солі (CH3COO)2Fe через кількість речовини (n=m/M, де М=Mrг/моль;
Mr((СH3COO)2Fe)=Ar(Fe)+4•Ar(C)+6•Ar(H)+4•Ar(O)=56+4•12+6•1+4•16=174, тому М(СH3COO)2Fe)=174 г/моль)
n((СH3COO)2Fe)=m((СH3COO)2Fe))/M((СH3COO)2Fe))=26,1 г : 174 г/моль=0,15 моль
2. Записуємо рівняння реакції: Fe+2СH3COOH -> (CH3COO)2Fe + H2↑
За рівнянням записуємо співвідношення кількостi речовини феруму і феруму (II) етаноату: n(Fe):n((CH3COO)2Fe)=1:1, кількості речовини однакові, тому n(Fe)=n((CH3COO)2Fe)=0,15 моль
3. Масу феруму кількістю речовини 0,15 моль обчислюємо за формулою m=n•M, де М=Mr г/моль
Mr((Fe)=Ar(Fe)=56, тому М(Fe)=56 г/моль
m(Fe)=n(Fe)•M(Fe)=0,15 моль•56 г/моль=8,4 г
Відповідь: 8,4 г.
Вправа 405. Кальцій карбонат — основний компонент накипу в чайнику. Для очищення чайнику від накипу його залили столовим оцтом. Після закінчення хімічної реакції виділився газ об’ємом 336 мл. Обчисліть масу накипу, що була в чайнику.
Відомо: V(СO2)=336 мл=0,336 л. Знайти: m(CaCO3)-?
Розв'язування
1. Виразимо об'єм СO2 через кількість речовини (n=V/VM, де VM - постійна величина і за н.у. чисельно дорівнює 22,4 л/моль)
n(CO2)=V(CO2)/VM=0,335 л : 22,4 л/моль = 0,015 моль
2. Записуємо рівняння реакції:
CaCO3 + 2CH3COOH -> (CH3COO)2Ca) + H2O+ CO2↑
За рівнянням записуємо співвідношення кількостi речовини кальцій карбонату і вуглекислого газу: n(CaCO3):n((CO2)=1:1, кількості речовини однакові, тому n(CaCO3)=n((CO2)=0,015 моль
3. Масу кальцій карбонату кількістю речовини 0,015 моль обчислюємо за формулою m=n•M, де М=Mr г/моль
Mr(CaCO3)=Ar(Ca)+Ar(C)+3•Ar(O)=40+12+3•16=100, тому
М(CaCO3)=100 г/моль.
m(CaCO3)=n(CaCO3)•M(CaCO3)=0,015 моль•100 г/моль=1,5 г
Відповідь: 1,5 г.
Вправа 406. Взаємодія соди з оцтом — один із процесів, необхідних для випікання тістечок (гасіння соди). Обчисліть масу столового оцту (масова частка кислоти 6%), необхідного для взаємодії з натрій карбонатом масою 5 г.
Відомо: m(Na2CO3)=5 г, ω(СH3COOH)=6%
Знайти: m(розчину)-?
Розв'язування
1. Виразимо масу натрій карбонату через кількість речовини (n=m/M, де М=Mrг/моль;
Mr((Na2CO3)=2•Ar(Na)+Ar(C)+3•Ar(O)=2•23+12+3•16=106, тому М(Na2CO3)=106 г/моль)
n((Na2CO3)=m((Na2CO3)/M((Na2CO3)=5 г : 106 г/моль=0,0471 моль
2. Записуємо рівняння реакції: Na2CO3+2СH3COOH -> 2CH3COONa+H2O+CO2↑
За рівнянням записуємо співвідношення кількостi речовини натрій карбонату і оцтової кислоти: n(CaCO3):n((CH3COOH)=1:2, кількість речовини оцтової кислоти удвічі більша, ніж кількість речовини натрій карбонату, тому
n(CH3COOH)=2•n(Na2CO3)=2•0,0471 моль=0,0942 моль
3. Масу оцтової кислоти кількістю речовини 0,0942 моль обчислюємо за формулою m=n•M,
де М=Mr г/моль
Mr(СH3COOH)=2•Ar(C)+4•Ar(H)+2•Ar(O)=2•12+4•1+2•16=60, тому
М(СH3COOH)=60 г/моль
m(СH3COOH)=n(СH3COOH)•M(СH3COOH)=0,0942 моль•60 г/моль=5,652 г
4. Обчислюємо масу розчину (оцту) за формулою
w(розчину)=(m(речовини)/ω(речовини))•100%:
m(розчину)=(m(СH3COOH)/ω(СH3COOH))•100%=(5,652 г:6%)•100% г=94,3 г
Відповідь: 94,3 г.