Вправа 407. Які сполуки відносять до вищих карбонових кислот (скорочено ВВК) ? Вищими карбоновими кислотами називають карбонові кислоти, у молекулах яких міститься від 12 до 22 атомів Карбону
Вправа 408. Наведіть молекулярні формули та назви вищих карбонових кислот, про які йшлося в параграфі.
C15H31COOH пальмітинова кислота, C17H35 стеаринова кислота, C17H33COOH олеїнова:, C17H31COOH лінолева, C17H29COOH ліноленова.
Які з них є насиченими, а які — ненасиченими?
Насичені вищі карбонові кислоти містять у молекулах лише прості ковалентні зв’язки між атомами Карбону С-С:
- CH3–(CH2)14–COOH пальмітинова кислота
- CH3–(CH2)16–COOH стеаринова кислота.
Ненаасичені вищі карбонові кислоти містять у молекулах подвійні зв’язки між атомами Карбону С=С:
- CH3–(CH2)7–CH=CH–(CH2)7–COOH олеїнова
- CH3–(CH2)4–CH=CH–CH2–CH=CH–(CH2)7–COOH лінолева
- CH3–CH2–CH=CH–CH2–CH=CH–CH2–CH=CH–(CH2)7–COOH ліноленова
Вправа 409. Які речовини є милом? Мила - солі вищих карбонових кислот з лужними елементами.
Чим вони відрізняються від ВКК? Мила, на відміну від вищих карбонових кислот, добре розчиняються у воді.
Вправа 410. Поясніть, чому ВКК нерозчинні у воді, а їхні солі — розчинні.
ВВК - неполярні молекулярні сполуки, тому не розчиняються у воді (полярному розчиннику), а їхні солі - йонні сполуки, тому добре розчиняються у воді.
Вправа 411. Опишіть мийну дію мила.
Для кращого розуміння: основною речовиною мила є розчинні у воді солі вищих карбонових кислот.
С17Н35СООNa → С17Н35СОО- + Na+
У прикладі аніон ВКК - це С17Н35СОО–
Нагадаємо: речовини, які складаються тільки з гідрофобних молекул, нерозчинні у воді, але розчинні в жирах. Речовини, які складаються з гідрофільних молекул, навпаки, добре розчиняються у воді, але в жирах нерозчинні.
Мийна дія мила пояснюється особливою будовою молекул солей, що входять до його складу.
У аніонів ВКК можна виділити сильнополярну «головку» (карбоксильну групу) та неполярний «хвіст» (карбоновий ланцюг). Неполярна частина йона - гідрофобний хвіст - «розчиняється» в жировій частині забруднення, а полярна - гідрофільна головка - залишається у воді, сполучаючись із її молекулами водневими зв’язками. Завдяки цьому у водному розчині солі ВКК утворюють специфічні частинки — міцели: в одному місці збирається багато аніонів ВКК, які орієнтуються так, щоб гідрофобні хвости були спрямовані всередину частинки, а гідрофільні «головки» — назовні, тобто до води. Завдяки утворенню міцел солі ВКК мають мийну дію. Краплинки жиру та інші частинки бруду є гідрофобними: якщо вони перебувають поблизу міцел, то «ховаються» від води всередині міцел і в такому вигляді плавають у воді. У такий спосіб жир стає розчинним у воді. Мийна дія полягає у сполученні аніонів мила з жировим забрудненням й відокремленні часточок бруду та перехід у воду у вигляді дрібних водорозчинних частинок.
Вправа 412. Як ви вважаєте, чому аніонам ПАР «вигідно» у водних розчинах утворювати міцели? Полярні групи молекул ПАР повертаються до води, оскільки вони є гідратовані, а вуглеводневі радикали виштовхуються з водної фази. Обидва ці процеси супроводжуються вивільненням теплоти, це сприяє зменшенню енергії системи і є енергетично вигідним.
Завдання для засвоєння матеріалу
Вправа 413. На прикладі стеаринової та пальмітинової кислот проілюструйте залежність температури плавлення органічних речовин одного класу від молекулярної маси. Температура плавлення пальмітинової кислоти -CH3-(CH2)14-COOH 630С, а стеаринової кислоти -CH3-(CH2)16-COOH - 700С. Із збільшенням карбонового ланцюга збільшується молекулярна маса й, відповідно, зростає температура плавлення.
Вправа 414. Як, на вашу думку, впливає насиченість органічних сполук на їхню температуру плавлення? Проілюструйте це на прикладі вищих карбонових кислот, описаних у параграфі. Температура плавлення насичених ВКК: 630С олеїнової та 700С стеаринової кислот, а ненасичених ВВК: 16,30С олеїнової, -50С лінолевої та -11,30С ліноленової кислот. Температура плавлення насичених ВКК є вищою, ніж ненасичених.
Вправа 415. До яких кислот — одноосновних чи багатоосновних — належать вищі карбонові кислоти, про які йшлося в параграфі? Із багатьох атомів Гідрогену, які містяться в молекулі вищих карбонових кислот, тільки один, що входить у карбоксильну групу –COOH, здатний відщеплюватися у вигляді катіона H+, тому вищі карбонові кислоти належать до одноосновних.
Вправа 416. Позначивши атом Карбону в складі карбоксильної групи молекули олеїнової кислоти номером один, розставте номери атомів Карбону всього ланцюга за порядком. Між якими (за номером) атомами Карбону утворений подвійний зв’язок у цій молекулі. Виконайте це для інших ненасичених вищих карбонових кислот, описаних у параграфі.
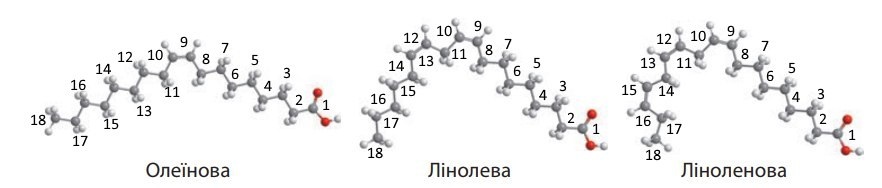
між 9-тим і 10-тим між 9-тим і 10-тим, між 9-тим і 10-тим,
між 12-мим і 13-мим між 12-мим і 13-тим,
між 15-тим і 16-тим
Вправа 417. Використовуючи інформацію про розчинність вищих карбонових кислот, зробіть висновок, полярними чи неполярними речовинами вони є. Вищі карбонові кислоти є нерозчинними у воді (полярному розчиннику), але добре розчинні в багатьох органічних розчинниках (неполярних), тому вони є неполярними речовинами.
Один з головних принципів, що визначає розчинність речовин: подібне розчиняється в подібному.
Вправа 418. Чи можуть частинки бруду бути гідрофільними? Відповідь поясніть. Так, але тоді вони будуть розчинятися і змиватися звичайною водою.
Вправа 419. Солі вищих карбонових кислот з лужними елементами розчинні у воді, а з йонами Кальцію або Магнію — нерозчинні. Складіть рівняння реакції обміну калій стеарату з кальцій хлоридом.
2C17H35COOK + CaCl2 = (C17H35COO)2Ca↓ + 2KCl
2C17H35COO- + 2K+ + Ca2+ + 2Cl- = (C17H35COO)2Ca↓ + 2K+ + 2Cl-
2C17H35COO- + Ca2+ = (C17H35COO)2Ca↓
2C17H35COOK + MgCl2 = (C17H35COO)2Mg↓ + 2KCl
2C17H35COO- + 2K+ + Mg2+ + 2Cl- = (C17H35COO)2Mg↓ + 2K+ + 2Cl-
2C17H35COO- + Mg2+ = (C17H35COO)2Mg↓
Вправа 420. Суміш пальмітинової та стеаринової кислот називають стеарином і використовують для виготовлення стеаринових свічок. Складіть рівняння реакції повного згоряння цих кислот, якщо в обох випадках продуктами реакцій є вуглекислий газ і вода. Який об’єм кисню (н. у.) знадобиться для спалювання свічки масою 200 г, якщо в стеарині однакові маси стеаринової та пальмітинової кислот.
Дано: m(C17H35COOН)=m(C15H31COOН)=100 г
Знайти: V(О2)-?
Розв'язування
І спосіб
Запишемо рівняння реакції горіння стеаринової та пальмітинової кислот:
100 г х л
С17Н35СООН + 26О2 → 18Н2О + 18СО2
284 г 582,4 л
100 г у л
С15Н31СООН + 23О2 → 16Н2О + 16СО2
260 г 515,2 л
Над формулами речовин записуємо дані, що є за умовою задачі, а під формулами сполук - об'єм та масу кількості речовини згідно з коефіцієнтами в хімічному рівнянні. За н.у. 1 моль газу займає об'єм 22,4 л, 23 моль займуть у 23 рази більший об'єм, тобто 515,2 л, а 26 моль - 584,2 л. Обчислюємо молярну масу (Mrг/моль=M) речовин й, відповідно, масу 1 моль.
Mr(С17H35СООН)=18•Ar(C)+36•Ar(H)+2•Ar(О)=18•12+36•1+2•16=284,
М(C17H35CООН)=284 г/моль, маса 1 моль=284 г
Mr(С15H31СООН)=16•Ar(C)+32•Ar(H)+2•Ar(О)=16•12+32•1+2•16=256,
М(C15H31CООН)=256 г/моль, маса 1 моль=256 г
За допомогою пропорції обчислюємо об'єм кисню в рівнянні (1):
х = 582,4 л • 100 г : 284 г
х = 205 л
За допомогою пропорції обчислюємо об'єм кисню в рівнянні (2):
х = 515,2 л • 100 г : 256 г
х = 201 л
Розраховуємо сумарний об'єм кисню:
V(O2)=х+y= 205 л + 201 л = 406 л
II спосіб
Обчислюємо кількість речовини стеаринової і пальмітинової кислот масою 100 г за формулою: v=m/M, де Mrг/моль=M
Mr(С17H35СООН)=18•Ar(C)+36•Ar(H)+2•Ar(О)=18•12+36•1+2•16=284,
М(C17H35CООН)=284 г/моль
v(C17H35CООН)=m(C17H35CООН):M(C17H35CООН)=100 г:284 г/моль=0,352 моль
Mr(С15H31СООН)=16•Ar(C)+32•Ar(H)+2•Ar(О)=16•12+32•1+2•16=260,
М(C15H31CООН)=256 г/моль
v(С15H31СООН)=m(С15H31СООН):M(С15H31СООН)=100 г:256 г/моль=0,391 моль
Запишемо рівняння реакції горіння стеаринової та пальмітинової кислот:
С17Н35СООН + 26О2 → 18Н2О + 18СО2 (1)
С15Н31СООН + 23О2 → 16Н2О + 16СО2 (2)
За рівнянням реакції (1) v(С17Н35СООН):v1(О2)=1:26, тому
v1(O2)=26•v(С17Н35СООН)=26•0,352 моль=9,152 моль
За рівнянням реакції (2) v(С15Н31СООН):v2(О2)=1:23, тому
v2(O2)=23•v(С17Н35СООН)=23•0,391 моль=8,993 моль
Обчислюємо об'єм кисню заданої кількості речовини за формулою V=v•VM, де VM - постійна величина і за н.у. дорівнює 22,4 л/моль.
V1(O2)=v1(O2)•VM=9,152 моль•22,4 л/моль=205 л
V2(O2)=v2(O2)•VM=8,993 моль•22,4 л/моль=201 л
Розраховуємо сумарний об'єм кисню:
V(O2)=V1(O2)+V2(O2)= 205 л + 201 л = 406 л
Відповідь: 406 л.
Вправа 421*. У додаткових джерелах знайдіть інформацію про харчові продукти, в яких використовують емульгатори. Поясніть роль емульгаторів у кожному випадку. Майонез, морозиво, масло, маргарин, спред, збиті вершки і багато інших харчових продуктів містять у своєму складі емульгатори. Ці харчові продукти є емульсіями, а емульсії мають здатність з часом розшаровуватися. Спеціальні речовини — емульгатори — дозволяють підтримувати необхідну консистенцію цих продуктів, тобто зберігати емульсію без змін тривалий час, щоб продукт не втрачав свого привабливого вигляду.