Вправа 163. Які сполуки називають ненасиченими вуглеводнями?
Ненасичені вуглеводні — це вуглеводні, у молекулах яких атоми Карбону сполучені не лише простими, а й кратними (подвійними, потрійними) зв’язками.
Вправа 164. Порівняйте етилен та ацетилен і заповніть таблицю:
Хімічна формула етилену С2Н4.
Електронна і структурна формули молекули етилену:
| Н | : | С | :: | С | : | Н | Н | ─ | С | = | С | ─ | Н | |
| .. | .. | │ | │ | |||||||||||
| Н | Н | Н | Н |
Хімічна формула ацитилену С2Н2.
Електронна і структурна формули молекули ацетилену:
| Н | : | С |
:: .. |
С | : | Н | Н | ─ | С | ≡ | С | ─ | Н |
| етилен | ацитилен | |
|
Фізичні властивості |
безбарвний газ зі слабким запахом, трохи легший за повітря, погано розчиняється у воді. За температури –104 °С і нормального тиску перетворюється на рідину. |
безбарвний газ майже без запаху, легший за повітря, погано розчиняється у воді. За температури –84 °С і нормального тиску зріджується.
|
Вправа 165. Охарактеризуйте будову молекули:
а) етилену; Гідроген одновалентний хімічний елемент, а Карбон в органічних сполуках - чотиривалентний. У молекулі етилену С2Н4 два неспарених електрони кожного атома Карбону беруть участь в утворенні двох спільних електронних пар; виникає подвійний зв’язок С=С. Інші два електрони кожного атома Карбону утворюють спільні електронні пари з двома атомами Гідрогену, внаслідок чого реалізуються прості ковалентні зв’язки С–Н. Усі атоми молекули перебувають на одній площині, а кути між лініями, що з’єднують центри атомів, становлять 120°:
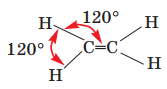
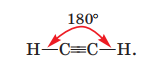
б) ацетилену. Гідроген одновалентний хімічний елемент, а Карбон в органічних сполуках - чотиривалентний. У молекулі ацетилен С2Н2 потрійний зв’язок С≡С зумовлений трьома спільними електронними парами, утвореними за участю трьох електронів кожного атома Карбону, а простий ковалентний зв’язок С–Н — електронною парою, спільною для атомів Карбону і Гідрогену. Центри всіх атомів молекули перебувають на прямій лінії:
Вправа 166. Який газ важчий — етилен чи ацетилен? Етилен
D=Mr1/Mr2, де Mr1, Mr2 - відносні молекулярні маси газів, а D - відносна густина.
Mr(C2H4)=2•Ar(C)+4•Ar(H)=2•12+4•1=28
Mr(C2H2)=2•Ar(C)+2•Ar(H)=2•12+2•1=26
DC2H2(C2H4)=Mr(C2H4)/Mr(C2H2)=28/26=1,1
У скільки разів? у 1,1 разів.
Вправа 167. Обчисліть густину етилену (за н. у.) та його відносну густину за повітрям.
Густина обчислюється за формулою ρ=M/VМ, де VM - постійна величина і за н.у. чисельно дорівнює 22,4 л/моль, a M=Mr г/моль.
Mr(С2Н4)=2•Аr(C)+4•Аr(Н)=2•12+4•1=28,
ρ(С2Н4)=28 г/моль : 22,4 л/моль = 1,25 г/л.
D=Mr1/Mr2, де Mr1, Mr2 - відносні молекулярні маси газів, а D - відносна густина.
Mr(C2H4)=2•Ar(C)+4•Ar(H)=2•12+4•1=28
Mr(повітря)=29
Dповітря(C2H4)=Mr(C2H4)/Mr(повітря)=28/29=0,966
Відповідь: ρ(С2Н4)=1,25 г/л, Dповітря(C2H4)=0,966
Вправа 168. Знайдіть масові частки елементів в ацетилені.
Масову частку елемента у сполуці обчислюємо за формулою
w(елемента)=n•Ar(елемента)/Mr(сполуки), де w(E) - масова частка; n — число атомів елемента; Аг(Е) — відносна атомна маса елемента; Мг(сполуки) — відносна молекулярна (формульна) маса сполуки.
w(С)=2•Ar(С)/Mr(С2Н2)=2•12/(2•12+2•1)=24/26=0,923 або,
помноживши це число на 100%, одержимо 92,3%
Масову частку Гідрогену знаходимо так:
100% - 92,3%=7,7 %
або так:
1 - 0,923=0,077
чи так:
w(Н)=2•Ar(Н)/Mr(С2Н2)=2•1/(2•12+2•1)=2/26=0,077 або 7,7%
Відповідь: w(С)=0,923 або 92,3%, w(Н)=0,077 або 7,7%.
Вправа 169. Обчисліть об’ємні частки метану й етену в їх суміші, якщо середня молярна маса суміші становить 25,6 г/моль.
Відомо: М(суміші)=25,6 г/моль. Знайти: φ(CH4)-?, φ(C2H4)-?
Розв'язування:
М(суміші)=φ1М1+φ2М2, де φ1,φ2 -об'ємні частки компонентів газової суміші, М1,М2 - молярні маси компонентів суміші, М(суміші)-середня молярна маса суміші.
M(CH4)=Ar(C)+4•Ar(H)=12+4•1=16 г/моль,
M(C2H4)=2•Ar(C)+4•Ar(H)=2•12+4•1=28 г/моль
Нехай об'ємна частка метану φ(CH4)=х, тоді об'ємна частка етену φ(C2H4)=1-х, підставивши змінні у формулу, отримуємо алгебраїчне рівняння і розв'язуємо його.
25,6 = 16х + 28(1-х)
25,6 = 16х + 28 - 28х
28х - 16х = 28 - 25,6
12х = 2,4
х = 2,4 : 12
х = φ(CH4)=0,2 або,
помноживши це число на 100%, одержимо 20%.
φ(C2H4)=1-0,2 = 0,8 або,
помноживши це число на 100%, одержимо 80%.
Відповідь: φ(CH4)=0,2 або 20%, φ(C2H4)=0,2 або 20%.