Вправа 1. Поясніть склад і будову молекул жирів. До складу жирів входять залишки молекул гліцеролу (гліцерину) і вищих карбонових кислот.
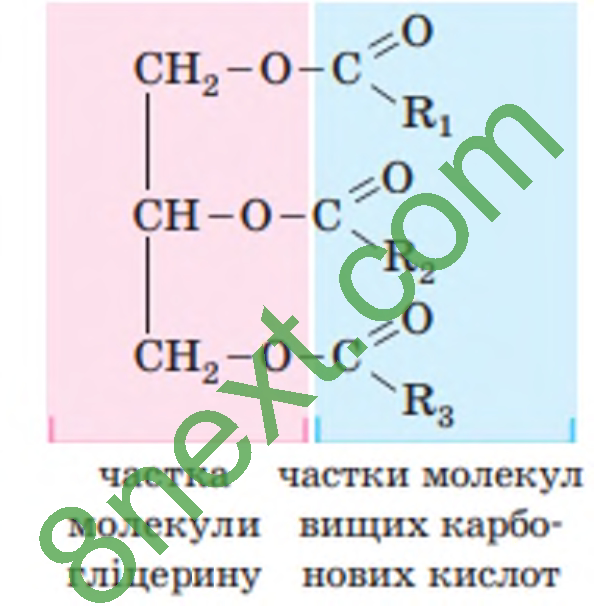
Тверді жири - тваринного походження, до складу яких входять залишки молекул насичених вищих карбонових кислот - пальмітинової С15H31—COOH і стеаринової C17H35—СOOH. Рідкі жири - рослинного походження, до складу яких входять залишки молекул ненасичених вищих карбонових кислот - олеїнової С17Н33—СООН, лінолевої С17Н31—СООН та ліноленової С17Н29—СООН.
Вправа 2. Охарактеризуйте фізичні властивості жирів.
Жири — маслянисті речовини, нерозчинні у воді, легші за неї, тому під час потрапляння у воду спливають на її поверхню, мають низькі температури плавлення, низьку теплопровідність.
Тввринні жири — тверді (виняток — рибячий жир). Рослинні жири — рідкі (виняток — кокосове масло, масло какао).
Вправа 3. Складіть скорочену структурну формулу жиру, до складу молекули якого входять залишки молекули гліцеролу й три залишки молекули пальмітинової кислоти.
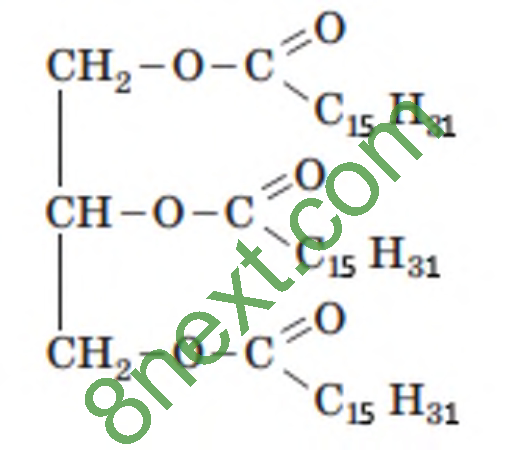
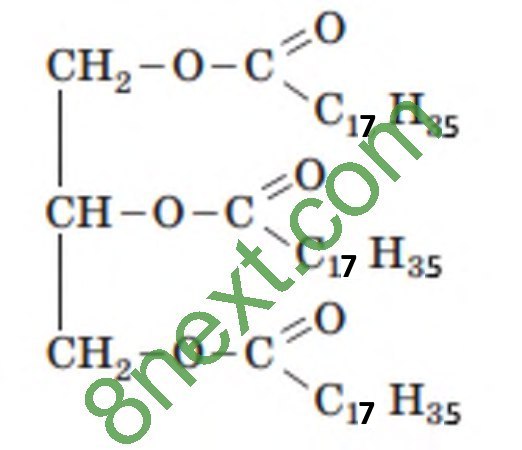
Вправа 4. Обчисліть масову частку Карбону в тристеариноаті.
Масову частку елемента у сполуці обчислюємо за формулою:
ω(E)=n•Ar(Е)/Mr(сполуки), де ω(E) - масова частка; n — число атомів елемента; Аг(Е) — відносна атомна маса елемента; Мг(сполуки) — відносна молекулярна (формульна) маса сполуки.
Mr(С3Н5(C17H35COO)3)=57•Ar(C)+110•Ar(H)+6•Ar(O)=57•12+110•1+6•16=890
ω(C)=57•Ar(C)/Mr(С3Н5(C17H35COO)3))=57•12/890=0,768, або,
помноживши це число на 100%, одержимо 76,8%.
Відповідь: 76,8%.
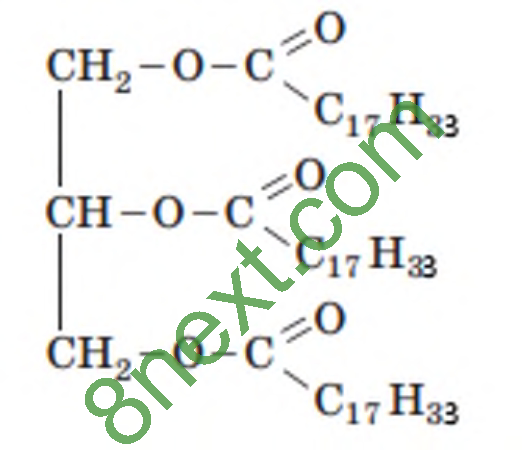
Вправа 5. Складіть молекулярну формулу жиру, до складу якого входять залишки гліцеролу й олеїнової кислоти. Обчисліть масову частку Оксигену в триолеаті.
Масову частку елемента у сполуці обчислюємо за формулою:
ω(E)=n•Ar(Е)/Mr(сполуки), де ω(E) - масова частка; n — число атомів елемента; Аг(Е) — відносна атомна маса елемента; Мг(сполуки) — відносна молекулярна (формульна) маса сполуки.
Mr(С3Н5(C17H33COO)3)=57•Ar(C)+104•Ar(H)+6•Ar(O)=57•12+104•1+6•16=884
ω(O)=6•Ar(O)/Mr(С3Н5(C17H33COO)3))=6•16/884=0,1086, або 10,86%,
Відповідь: 10,86%.
Вправа 6. У результаті реакції між олеїновою кислотою та натрій гідроксидом утворилася сіль масою 212,8 кг. Обчисліть маси вихідних речовин. Назвіть утворену сіль.
Відомо: m(С17Н33СООNa)=212,8 кг
Знайти: m(С17Н33СООН)-?, m(NaOH)-?
Розв'язування.
І спосіб
Записуємо рівняння реакції:
х кг у кг 212,8 кг
C17H33СOOH + NaOH → C17Н33COONa + H2O
282 кг 40 кг 304 кг
Над формулами речовин записуємо дані, що є за умовою задачі.
Мольні співвідношення речовин показують коефіцієнти рівняння. Прореагувало 1 кмоль олеїнової кислоти C17H33COOH і 1 кмоль натрій гідроксиду NaOH з утворенням 1 кмоль натрій олеїноату C17H33COONa. Обчислюємо молярні маси (Mr кг/кмоль = M) речовин й, відповідно, масу 1 кмоль.
Mr(C17H33COOH)=18•Ar(C)+34•Ar(Н)+2•Ar(О)=18•12+34•1+2•16=282,
M(C17H33COOH)=282 кг/кмоль. Маса 1 кмоль=282 кг.
Mr(NaOH)=Ar(Na)+Ar(O)+Ar(H)=23+16+1=40,
M(NaOH)=40 кг/кмоль. Маса 1 кмоль=40 кг.
Mr(C17H33COONa)=18•Ar(C)+33•Ar(Н)+2•Ar(О)+Ar(Na)=18•12+32•1+2•16+23=
=304, M(C17H33COONa)=304 кг/кмоль. Маса 1 кмоль=304 кг.
Записуємо під формулами речовин у рівнянні реакції.
За допомогою пропорції обчислюємо масу олеїнової кислоти:
х кг/ 282 кг = 212,8 кг / 304 кг, звідси
х кг • 304 кг = 212,8 кг • 282 кг
х = 212,8 кг • 282 кг : 304 кг
х =m(C17H33COOH)=197,4 кг
За допомогою пропорції обчислюємо масу натрій гідроксиду:
у кг/ 40 кг = 212,8 кг / 304 кг, звідси
у кг • 304 кг = 212,8 кг • 40 кг
у = 212,8 кг • 40 кг : 304 кг
у =m(NaOH)=28 кг
ІІ спосіб
Обчислюємо кількість речовини натрій олеїноату масою 212,8 кг за формулою v=m/M, де
Mr кг/кмоль=M.
Mr(C17H33COONa)=18•Ar(C)+33•Ar(Н)+2•Ar(О)+Ar(Na)=18•12+32•1+2•16+23=
=304, M(C17H33COONa)=304 кг/кмоль
v(C17H33COONa)=m(C17H33COONa):M(C17H33COONa)=212,8 кг:304 кг/кмоль=
=0,7 кмоль.
Записуємо рівняння реакції:
C17H33СOOH + NaOH → C17Н33COONa + H2O
Мольні співвідношення речовин показують коефіцієнти рівняння.
Прореагувало 1 кмоль олеїнової кислоти C17H33COOH і 1 кмоль натрій гідроксиду NaOH з утворенням 1 кмоль натрій олеїноату C17H33COONa, кількості речовини однакові, тому
v(C17H33COOН)=v(NaOH)=v(C17H33COONa)=0,7 кмоль
Обчислюємо масу заданої кількості речовини за формулою: m=v•M, де Мr кг/кмоль=М.
Mr(C17H33COOH)=18•Ar(C)+34•Ar(Н)+2•Ar(О)=18•12+34•1+2•16=282,
M(C17H33COOH)=282 кг/кмоль.
m(C17H33COOH)=v(C17H33COOH)•M(C17H33COOH)=0,7 кмоль • 282 кг/кмоль=
=197,4 кг.
Mr(NaOH)=Ar(Na)+Ar(O)+Ar(H)=23+16+1=40, M(NaOH)=40 кг/кмоль.
m(NaOH)=v(NaOH)•M(NaOH)=0,7 кмоль•40 кг/кмоль=28 кг.
Відповідь: 197,4 кг C17H33COOН і 28 кг NaOH, натрій олеїноат.
Вправа 7. У реакцію з пальмітиновою кислотою вступив калій гідроксид масою 280 кг. Обчисліть, яка маса пальмітинової кислоти витратилася, а маса калій пальмітату утворилася. Якій кількості речовини відповідає така маса калій пальмітату?
Відомо: m(KOH)=280 кг
Знайти: m(С15Н31СООН)-?, m(С15Н31СООK)-?, v(С15Н31СООK)-?
Розв'язування.
І спосіб
Записуємо рівняння реакції:
х кг 280 кг у кг
C15H31СOOH + KOH → C15Н31COOK + H2O
256 кг 56 кг 294 кг
Над формулами речовин записуємо дані, що є за умовою задачі.
Мольні співвідношення речовин показують коефіцієнти рівняння. Прореагувало 1 кмоль пальмітинової кислоти C15H31COOH і 1 кмоль калій гідроксиду KOH з утворенням 1 кмоль калій пальмітату C15H31COOК. Обчислюємо молярні маси (Mr кг/кмоль = M) речовин й, відповідно, масу 1 кмоль.
Mr(C15H31COOH)=16•Ar(C)+32•Ar(Н)+2•Ar(О)=16•12+32•1+2•16=256,
M(C15H31COOH)=256 кг/кмоль. Маса 1 кмоль=256 кг.
Mr(KOH)=Ar(K)+Ar(O)+Ar(H)=39+16+1=56,
M(KOH)=56 кг/кмоль. Маса 1 кмоль=56 кг.
Mr(C15H31COOK)=16•Ar(C)+31•Ar(Н)+2•Ar(О)+Ar(K)=16•12+31•1+2•16+39=
=294, M(C15H31COOK)=294 кг/кмоль. Маса 1 кмоль=294 кг.
Записуємо під формулами речовин у рівнянні реакції.
За допомогою пропорції обчислюємо масу пальмітинової кислоти:
х кг/ 256 кг = 280 кг / 56 кг, звідси
х кг • 56 кг = 256 кг • 280 кг
х = 256 кг • 280 кг : 56 кг
х =m(C15H31COOH)=1280 кг
За допомогою пропорції обчислюємо масу калій пальмітату:
280 кг/ 56 кг = у кг / 294 кг, звідси
у кг • 56 кг = 294 кг • 280 кг
х = 294 кг • 280 кг : 56 кг
х =m(C15H31COOK)=1470 кг
Обчислюємо кількість речовини калій пальмітату масою 1470 кг за формулою v=m/M.
v(C15H31COOК)=m(C15H31COOК):M(C15H31COOК)=1470 кг:294 кг/кмоль=5 кмоль.
ІІ спосіб
Обчислюємо кількість речовини калій гідроксиду масою 280 кг за формулою v=m/M, де
Mr кг/кмоль=M.
Mr(KOH)=Ar(K)+Ar(O)+Ar(H)=39+16+1=56, M(KOH)=56 кг/кмоль.
v(KOH)=m(KOH):M(KOH)=280 кг:56 кг/кмоль=5 кмоль.
Записуємо рівняння реакції:
C15H31СOOH + КOH → C15Н31COOК + H2O
Мольні співвідношення речовин показують коефіцієнти рівняння.
Прореагувало 1 кмоль пальмітинової кислоти C15H31COOH і 1 кмоль калій гідроксиду KOH з утворенням 1 кмоль калій пальмітату C15H31COOК, кількості речовини однакові, тому
v(C15H31COOН)=v(C15H31COOК)=v(КOH)=5 кмоль
Обчислюємо масу заданої кількості речовини за формулою: m=v•M, де Мr кг/кмоль=М.
Mr(C15H31COOH)=16•Ar(C)+32•Ar(Н)+2•Ar(О)=16•12+32•1+2•16=256,
M(C15H31COOH)=256 кг/кмоль.
m(C15H31COOH)=v(C15H31COOH)•M(C15H31COOH)=5 кмоль • 256 кг/кмоль=
=1280 кг.
Mr(C15H31COOK)=16•Ar(C)+31•Ar(Н)+2•Ar(О)+Ar(K)=16•12+31•1+2•16+39=
=294, M(C15H31COOK)=294 кг/кмоль.
m(C15H31COOK)=v(C15H31COOK)•M(C15H31COOK)=5 кмоль•294 кг/кмоль=
=1470 кг.
Відповідь: 1280 кг C15H31COOH, 1470 кг C15H31COOK, 5 кмоль.
Вправа 8. Перемалюйте кросворд у зошит і розв’яжіть його. У виділеному стовпчику прочитаєте назву триатомного спирту. ГЛІЦЕРОЛ
1. Реакція, характерна для всіх органічних речовин. Горіння
2. Вища карбонова ненасичена кислота. Олеїнова
3. Процес розпаду на йони. Дисоціація
4. Традиційна назва солей етанової кислоти. Ацетати
5. Зв’язок між молекулами полярних сполук. Водневий
6. Органічні сполуки, до складу яких входить гідроксильна група. Спирти
7. Назва розчину етанової кислоти. Оцет
8. Назва рідкого жиру. Олія