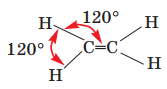
Вправа 1. Поясніть склад і будову молекул етену й етину. Що в них подібне, а що — відмінне? У складі етену (етилену), порівняно з насиченим вуглеводнем етаном, є на два атоми Гідрогену менше, тому атоми Карбону утворюють хімічні зв’язки між собою, витрачаючи по два валентні електрони, отже, між ними виникають дві спільні електронні пари. Такий зв’язок називають подвійним. Два інші валентні електрони кожного атома Карбону утворюють ковалентний зв’язок з атомами Гідрогену. Молекула етену плоска, тобто всі атоми розміщені в одній площині, валентний кут становить 120°.
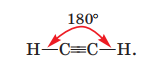
У складі етину (ацетилену), порівняно з насиченим вуглеводнем етаном, є на чотири атоми Гідрогену менше, тому атоми Карбону утворюють хімічні зв’язки між собою, витрачаючи по три валентні електрони, отже, між ними виникають три спільні електронні пари. Такий зв’язок називають потрійним. Два інші валентні електрони кожного атома Карбону утворюють ковалентний зв’язок з атомами Гідрогену. Молекула етину лінійна, валентний кут становить 180°.
Подібне: однаковий якісний склад (молекули складаються з атомів Карбону і Гідрогену).
Відмінне: кратність (подвійний, потрійний) хімічного зв'язку між атомами Карбону, кількісний склад.
Вправа 2. Охарактеризуйте фізичні властивості:
а) етену;
Етен - безбарвний газ, має слабкий солодкуватий запах, за низьких температур зріджується й твердне, малорозчинний у воді, але добре розчиняються у вуглеводнях, температура плавлення –169,2 °С, температура кипіння –83,8 °С.
б) етину.
Етин - безбарвний газ, не має запаху, за низьких температур зріджується й твердне, у воді розчиняється краще, ніж етен, трохи легший за повітря, температура плавлення –80,8 °С, температура кипіння –83,8 °С.
Вправа 3. Порівняйте реакції горіння метану, етену й етину. Поясніть результати порівнянь. Метан горить майже безбарвним полум'ям. Полум'я етену і етину світиться, причому етин горить з виділенням більшої кількості кіптяви. У полум’ї наявні розжарені частинки вуглецю, які спричиняють його свічення. Це пояснюється складом молекул цих вуглеводнів. Масова частка Карбону в метані становить 75%, а етені — 86%, в етині - 92%.
Вправа 4. Позначте суму коефіцієнтів у реакції горіння пентену С5Н10.
| А 39 | Б 38 | В 37 | Г 36 |
2C5H10 + 15O2 = 10CO2 + 10H2O, 2+15+10+10=37
Вправа 5. Установіть відповідність між правими та лівими частинами рівнянь реакцій.
|
А 2С2Н6 + 7О2 Б 2С2Н2 + 5О2 В С2Н4 + Br2 Г С2Н4 + 3О2 |
1 CH2Br– CH2Br 2 4CO2 + 6H2O 3 4CO2 + 2H2O 4 2CO2 + 2H2O |
Вправа 6. Обчисліть і вкажіть молекулярну формулу сполуки, якщо за нормальних умов об’єм цієї сполуки масою 1,16 г становить 1 л.
| А С2Н4 | Б С2Н6 | В С3Н6 | Г С2Н2 |
Mr(C2H4)=2•Ar(C)+4•Ar(H)=2•12+4•1=28, M(C2H4)=28 г/моль.
Mr(C2H6)=2•Ar(C)+6•Ar(H)=2•12+6•1=30, M(C2H6)=30 г/моль.
Mr(C3H6)=3•Ar(C)+6•Ar(H)=3•12+6•1=42, M(C3H6)=42 г/моль.
Mr(C2H2)=2•Ar(C)+2•Ar(H)=2•12+2•1=26, M(C2H2)=26 г/моль.
Молярну масу газуватої сполукти легко обчислити, знаючи масу 1 літра: M=Vм•ρ, де Vм - молярний об'єм газу і за н.у. рівний 22,4 л/моль, а ρ - густина газу, тобто маса 1 літра за нормальних умов.
ρ= m/V =1,16 г : 1 л = 1,16 г/л
М(сполуки)=22,4 л/моль • 1,16 г/л = 25,986 г/моль ≈26 г/моль
Отже, цією сполукою є етин С2Н2.
Вправа 7. Алкан кількістю речовини 0,25 моль має масу 18 г. Обчисліть його відносну молекулярну масу та встановіть формулу. Обчисліть об’єм кисню (н. у.), який треба витратити для повного спалювання цього алкану масою 14,4 г.
Відомо: v(СnН2n+2)=0,25 моль, m(СnН2n+2)=18 г.
Знайти: формула алкану-? V(O2)-?
Розв'язування:
З формули обчислення кількості речовини v=m/M, де M=Mr г/моль, знаходимо молярну масу речовини M=m/v.
M(СnН2n+2)=m(СnН2n+2)/v(СnН2n+2)=18 г : 0,25 моль=72 г/моль,
тоді Мr(СnН2n+2)=72.
Загальна формула алканів СnH2n+2, тому
Mr(СnH2n+2)=Ar(C)•n+Ar(H)•(2n+2)=12•n+1•(2n+2)=12n+2n+2=14n+2
Складаємо рівняння і розв'язуємо його.
14n+2=72
14n = 70
n=70:14
n=5
Отже, формула алкану С5Н12.