Знаємо, розуміємо
1. Яку просторову будову має молекула води? Кутову.
Ковалентні полярні зв'язки в молекулі води утворюються за рахунок двох неспарених р-електронів атома Оксигену, що містяться на окремих двох р-орбіталях, та s-електронів атомів Гідрогену. Дві р-орбіталі направлені вздовж осей координат - х, у, розміщені під кутом 900. Ядра атомів Гідрогену позитивно заряджені (однойменні), тому частково відштовхуються і кут збільшується до 104,50.
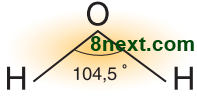
Як це впливає на утворення водневого зв’язку й розчинення речовин? З боку атома Оксигену зосереджується негативний заряд δ-, з боку атомів Гідрогену — позитивний заряд δ+, обидва атоми Гідрогену розміщені по один бік від атома Оксигену, що й зумовлює наявність у молекули води двох електричних полюсів, тому молекула води є диполем. Диполям молекул води цілком достатньо часткових зарядів, щоб виникла сила притягання між атомом Гідрогену однієї молекули та атомом Оксигену іншої й утворився водневий зв’язок. У воді (полярному розчиннику) добре розчиняються речовини молекулярної будови, що мають полярні молекули, а також речовини йонної будови.
Будовою молекули води (диполь) і здатністю молекул утворювати водневі зв'язки пояснюється механізм розчинення речовин у воді.
2. Поясніть, як утворюється водневий зв’язок між молекулами води. Молекули-диполі води притягуються одна до одної внаслідок електростатичної взаємодії між атомами Гідрогену та Оксигену різних молекул. Таку взаємодію називають водневим зв'язком.
3. Наведіть по два приклади розчинних, малорозчинних і практично нерозчинних у воді речовин — представників різних класів неорганічних сполук.
| Розчинні | Малорозчинні | Нерозчинні |
|
HCl NaCl |
CaCO3 Ca(OH)2 |
AgCl2 Cu(OH)2 |
4. Які фізичні властивості води зумовлені наявністю між її молекулами водневого зв’язку? Аномально висока як для речовин молекулярної будови, температура кипіння, рідкий агрегатний стан за звичайних умов, здатність розчиняти багато речовин.
5. Які ще елементи, окрім Гідрогену, можуть утворювати водневий зв’язок? Оксиген, Нітроген, Флуор.
6. Поясніть, як підвищення тиску впливає на розчинність газів. За підвищення тиску розчинність газоподібних речовин зростає, бо розчинність прямо пропорційна тиску. Щоб розчинити якомога більше газуватої речовини в певному об’ємі, розчинення слід проводити за підвищеного тиску.
7. Поясніть, як температура впливає на розчинність газів. Розчинність газів з підвищенням температури зменшується. Пояснюється це тим, що нагрівання прискорює рух молекул, унаслідок чого частина з них залишає розчин. Щоб розчинити якомога більше газуватої речовини в певному об’ємі, розчинення слід проводити за зниженої температури.
8. Чому між молекулами води існує водневий зв’язок, а між молекулами гідроген сульфіду — ні? Різною є різниця значення електронегативності елементів VI групи головної підгрупи. В Оксигену електронегативність більша, ніж у Сульфуру. Тому в молекулі води спільні електронні пари сильніше зміщені до Оксигену порівняно зі зміщенням спільних електронних пар у молекулі гідроген сульфіду. Часткових зарядів, що виникають при цьому, у молекулах води достатньо для утворення водневого зв’язку, а в молекулах гідроген сульфіду — ні.
Обов’язкова умова утворення водневого зв'язку — наявність у молекулі атома Гідрогену, сполученого з атомом більш електронегативного елемента (Флуору, Оксигену, Нітрогену).
Застоовуємо
Вправа 26. Зазначте характеристику, за якою укладено такий перелік речовин: натрій карбонат, кальцій хлорид, хлоридна кислота, калій гідроксид.
А оксигеновмісні речовини
Б речовини з йонним хімічним зв’язком
В добре розчинні у воді речовини
Г речовини, що відрізняються за агрегатним станом
Вправа 27. Користуючись графіками розчинності у воді деяких солей (мал. 11), з’ясуйте, якою є розчинність кожної з речовин за температури +450С.
Розчинність калій сульфату K2SO4 за температури +45оС 10 г на 100 г води.
Розчинність барій нітрату Ba(NO3)2 за температури +45оС 10 г на 100 г води.
Розчинність натрій хлориду NaCl за температури +45оС 44 г на 100 г води.
Розчинність калій хлориду KCl за температури +45оС 45 г на 100 г води.
Розчинність барій хлориду BaCl за температури +45оС 50 г на 100 г води.
Розчинність магній сульфату MgSO4 за температури +45оС 54 г на 100 г води.
Вправа 28. Користуючись малюнком 11, розташуйте назви солей у послідовності збільшення розчинності цих речовин за температури +800С. БГАВ
А барій хлорид
Б калій сульфат
В магній сульфат
Г барій нітрат
Вправа 29. Обчисліть масову частку натрій хлориду в його насиченому за температури +200С розчині.
За кривою розчинності визначаємо, що у 100 г води за 20 °С можна розчинити 36 г NaCl, тоді розчин буде насиченим.
Відомо: m(H2O)=100 г, m(NaCl)=36 г. Знайти: ω(NaCl)-?
Розв'язування.
І спосіб
1. Знаходимо масу розчину.
m(розчину)=m(NaCl)+m(Н2О)=36 г +100 г = 136 г
2. Знаходимо масову частку речовини в розчині за формулою:
ω(речовини)=(m(речовини)/m(розчину))•100%
ω(NaCl)=(m(NaCl)/m(розчину))•100%=(36 г/136 г)•100%=26,5%.
ІІ спосіб
1. Знаходимо масу розчину.
m(розчину)=m(NaCl)+m(Н2О)=36 г +100 г = 136 г
2. Визначаємо масу розчиненої речовини, що міститься у 100 г розчину, тобто, масову частку. Для цього складаємо пропорцію і розв'язуємо її:
у 136 г розчину розчинено 36 г NaCl, тоді
у 100 г розчину розчиниться х г NaCl.
136 г / 100 г = 36 г / х г, звідси
х г • 136 г = 36 г • 100 г
х = (36 г • 100 г) : 136 г
х = 26,5 г, тому ω(NaCl) = 26,5%
Відповідь: в насиченому розчині натрій хлориду за температури 20°С масова частка солі становить 26,5%.
Вправа 30. Який тип хімічного зв’язку в молекулі вуглекислого газу? Ковалентний полярний. Чи здатна ця речовина утворювати диполі, якщо у просторі всі атоми в цій молекулі розміщені на одній лінії, тобто валентний кут дорівнює 1800? Відповідь обґрунтуйте. Молекула має симетричну лінійну будову О=С=О, тому не дивлячись на те, що зв'язки С=О полярні, проте внаслідок взаємної компенсації їхніх дипольних елементів молекула СО2 в цілому неполярна, тому не здатна утворювати диполі.