Знаємо, розуміємо
1. Схарактеризуйте кількісний і якісний склад етанолу та гліцеролу.
Молекула етанолу містить 2 атоми Карбону, 1 атом Оксигену і 6 атомів Гідрогену, а молекула гліцеролу - 3 атоми Карбону, 3 атоми Оксигену і 8 атомів Гідрогену.
Якісний склад сполуки вказує, які елементи входять до її складу.
Кількісний склад вказує, скільки атомів кожного елемента входить до її складу.
2. Схарактеризуйте фізичні властивості:
а) етанолу; Етанол — легкокипляча безбарвна рідина (температура кипіння +78,40С) зі специфічним запахом, легший за воду, змішується з нею в будь-яких відношеннях. Етанол не лише розчиняється у воді, а й сам є розчинником багатьох речовин. Етанол — легкозаймиста речовина.
б) гліцеролу. Гліцером - безбарвна, в’язка, сиропоподібна, без запаху, солодка на смак, важча за воду й неотруйна рідина, добре розчиняється у воді, має здатність поглинати вологу з повітря та утримувати її.
3. Назвіть властивості етанолу і гліцеролу, які зумовлюють їхнє використання. Етанол є добрим розчинником для органічних і неорганічних сполук, хорошим антисептиком (знезаражувачем). Гліцером є добрим розчинником для органічних і неорганічних сполук, дуже гігроскопічний (поглинає водяну пару з повітря).
4. За допомогою якої якісної реакції можна виявити гліцерол? Якісною реакцією на гліцерол та інші багатоатомні спирти є їх взаємодія зі свіжодобутим осадом купрум (ІІ) гідроксидом й утворенням розчину яскраво-синього кольору.
5. Чим небезпечне вживання напоїв, що містять етанол? Етанол руйнує нервову систему, робить організм вразливим до серцево-судинних захворювань, спричинює захворювання органів травлення, порушує пам’ять, Він має наркотичну дію, тобто викликає залежність, що призводить до захворювання на алкоголізм.
Застосовуємо
Вправа 127. Оцініть згубну дію алкоголю на здоров’я. Вживання навіть невеликих доз спиртного утруднює передавання нервових імпульсів, призводить до розладу активного мислення, відмирання клітин мозку.
Вправа 128. Запишіть молекулярні, електронні та структурні формули метанолу, етанолу, гліцеролу. Обчисліть, у якій із цих сполук масова частка Оксигену найбільша.
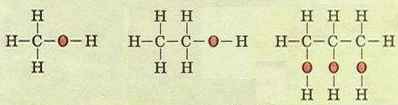
Молекулярні формули: CH4O (пишуть СН3ОН) - метанол , C2H6O (пишуть С2Н5ОН) - етанол, C3H8O3 (пишуть С3Н5(ОН)3)- гліцерол.
Електронні формули метанолу, етанолу, гліцеролу.
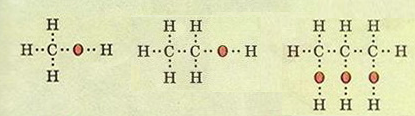
Структурні формули метанолу, етанолу, гліцеролу.
Масову частку елемента у сполуці обчислюємо за формулою
w(елемента)=n•Ar(елемента)/Mr(сполуки)
Знаходимо відносну молекулярну масу метанолу і масову частку Оксигену в метанолі.
Mr(CH4O)=Ar(C)+4•Ar(H)+Ar(O)=12+4•1+16=32
w(O)=Ar(O)/Mr(CH4O)=16/32=0,5, або,
помноживши це число на 100%, одержимо 50%
Знаходимо відносну молекулярну масу етанолу і масову частку Оксигену в етанолі.
Mr(C2H6O)=2•Ar(C)+6•Ar(H)+Ar(O)=2•12+6•1+16=46
w(O)=Ar(O)/Mr(C2H6O)=16/46=0,35, або 35%
Знаходимо відносну молекулярну масу гліцеролу і масову частку Оксигену в гліцеролі.
Mr(C3H8O3)=3•Ar(C)+8•Ar(H)+3•Ar(O)=3•12+8•1+3•16=92
w(O)=3•Ar(O)/Mr(C3H8O3)=3•16/92=0,52, або 52%
Відповідь: найбільша масова частка Оксигену в гліцеролі.
Вправа 129. Складіть рівняння реакції горіння метанолу й обчисліть об’єм кисню (н.у.), необхідний для спалювання метанолу кількістю речовини 4 моль.
Відомо: v(СН4О)=4 моль. Знайти: V(О2)-?
Розв'язування:
І спосіб
Записуємо рівняння реакції: 2CH4O+3O2=2CO2+4H2O
Мольні співвідношення речовин показують коефіцієнти рівняння.
Прореагувало 2 моль метанолу СН4О з 3 моль кисню О2, співвідношення між кількістю речовини метанолу та кисню становить 2:3=1:1,5, тобто для спалювання будь-якої кількості речовини метанолу кисню витрачається у 1,5 разів більше, тому
v(О2)=1,5•v(СН4О)=1,5•4 моль= 6 моль.
Знаходимо об'єм кисню кількістю речовини 6 моль за формулою V=v•Vm, де Vm-постійна величина і за н.у. дорівнює 22,4 л/моль.
V(О2)=v(О2)•22,4 г/моль=6 моль•22,4 л/моль=134,4 л.
ІІ спосіб
Записуємо рівняння реакції:
4 моль х л
2CH4O + 3O2 = 2CO2 + 4H2O
2 моль 67,2 л
Над формулами речовин записуємо дані, що є за умовою задачі.
Мольні співвідношення речовин показують коефіцієнти рівняння.
Прореагувало 2 моль метанолу СН4О з 3 моль кисню О2 (1 моль газу за н.у. займає об'єм 22,4 л, а 3 моль займуть утричі більший об'єм, тобто 67,2 л).
Відповідні значення записуємо під формулами речовин у рівнянні реакції.
За допомогою пропорції обчислюємо об'єм кисню.
4 моль/ 2 моль = х л / 67,2 л, звідси
х л • 2 моль = 4 моль • 67,2 л
х = 4 моль • 67,2 л / 2 моль
х =134,4 л.
Відповідь: V(О2)=134,4 л.
Вправа 130. Напишіть рівняння реакції горіння пропанолу С3Н7ОН (або С3Н8О) за аналогією з етанолом та обчисліть, який об’єм кисню (н.у.) потрібний для спалювання 90 г цього спирту.
Відомо: m(C3H8O)=90 г. Знайти: V(O2)-?
Розв'язування:
І спосіб
Записуємо рівняння реакції: 2C3H8O+9O2=6CO2+8H2O
Обчислюємо кількість речовини пропанолу масою 90 г за формулою v=m/M, де M=Mrг/моль.
Mr(С3Н8О)=3•Ar(С)+8•Ar(H)+Ar(O)=3•12+8•1+16=60, M(C3H8O)=60 г/моль.
v(С3Н8О)=m(С3Н8О) : Mr(С3Н8О)=90 г : 60 г/моль=1,5 моль
Мольні співвідношення речовин показують коефіцієнти рівняння.
Прореагувало 2 моль пропанолу C3H7OH з 9 моль кисню О2, співвідношення між кількістю речовини пропанолу та кисню становить 2:9 або 1:4,5, тоді кількість речовини кисню порівняно з кількістю речовини пропанолу буде у 4,5 рази більша, тому
v(О2)=4,5•v(С3Н8О)=4,5•1,5 моль= 6,75 моль.
Знаходимо об'єм кисню кількістю речовини 6,75 моль за формулою V=v•Vm, де Vm-постійна величина і за н.у. дорівнює 22,4 л/моль.
V(О2)=v(О2)•22,4 г/моль=6,75 моль•22,4 л/моль=151,2 л.
ІІ спосіб
Записуємо рівняння реакції:
90 г х л
2C3H8O + 9O2 = 6CO2 + 8H2O
120 г 201,6 л
Над формулами речовин записуємо дані, що є за умовою задачі.
Мольні співвідношення речовин показують коефіцієнти рівняння.
Прореагувало 2 моль пропанолу C3H7OH з 9 моль кисню О2 (1 моль газу за н.у. займає об'єм 22,4 л, а 9 моль газу займуть у 9 разів більший об'єм, тобто 201,6 л). Обчислюємо молярну масу (M=Mr г/моль) пропанолу й, відповідно, масу 2 моль.
Mr(С3Н8О)=3•Ar(С)+8•Ar(H)+Ar(O)=3•12+8•1+16=60, M(C3H8O)=60 г/моль.
Маса 1 моль=60 г, а маса 2 моль=120 г.
Відповідні значення записуємо під формулами речовин у рівнянні реакції.
За допомогою пропорції обчислюємо об'єм кисню.
90 г / 120 г = х л / 201,6 л, звідси
х л • 120 г = 90 г • 201,6 л
х = 90 г • 201,6 л / 120 г
х =151,2 л.
Відповідь: V(О2)=151,2 л.
Вправа 131. У розчин етанолу масою 70 г з масовою часткою розчиненої речовини 30% долили 130 мл води. Обчисліть масову частку спирту в утвореному розчині.
Відомо: m1(розчину)=70 г, w1(C2H6O)=30%, V(Н2О)=130 мл.
Знайти: w2(С2Н6О) -?
Знаходимо масу речовини (спирту) у початковому розчині за формулою:
m(речовини)=(m(розчину)•w(речовини)) : 100%
1. m1(C2H6O)=(m1(розчину)•w1(C2H6O)):100%=(70 г•30%):100%=21 г.
Знаходимо масу води за формулою:
m = V•ρ, де густина води ρ=1 г/мл.
2. m(Н2О)=130 мл • 1 г/мл=130 г. Бачимо, що для води об'єм відповідає масі, тому ця дія не є обов'язковою.
Знаходимо масу нового розчину:
3. m2(розчину)=m1(розчину)+m(Н2О)= 70 г+130 г=200 г.
Знаходимо масову частку речовини в утвореному розчині за формулою:
w(речовини)=(m(речовини)/m(розчину))•100%
4. w2(С2Н6О)=(m1(C2H6O)/m2(розчину))•100%=(21 г/200 г)•100%=
=0,105•100%=10,5%