![]()
САМОСТІЙНА РОБОТА (ФРОНТАЛЬНА)
Завдання 1 Поясніть, з огляду на будову атомів, чому на проміжку Na─Mg─АІ металічні властивості елементів послаблюються.
У межах періоду із зростанням зарядів ядер атомів і зменшення радіуса, посилюється притягання ядром електронів зовнішнього енергетичного рівня. Властивість віддавати електрони послаблюється, а приєднувати ─ посилюється, тому металічні властивості елементів послаблюються, а неметалічні ─ посилюються.
Завдання 2 Напишіть формули оксидів і гідроксидів металічних елементів 3, 11,19 та поясніть, як зміниться їх хімічна активність залежно від місця у підгрупі.
|
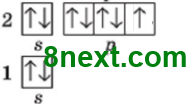
Літій №3 ) ) 2 1 |
Натрій №11 ) ) ) 2 8 1 |
Калій №19 ) ) ) ) 2 8 8 1 |
|
Li2O LiOH |
Na2O NaOH |
K2O KOH |
У межах групи елементів головної підгрупи із зростанням зарядів ядер атома будова зовнішнього енергетичного рівня атома є однакова, але зростає число енергетичних рівнів, тобто радіус атома. Чим далі від ядра розташовані валентні електрони, тим менше вони притягуються до ядра. Завдяки цьому атоми Калію втрачають електрони легше, ніж атоми Натрію чи Літію. Здатність віддавати електрони посилюється, хімічна активність у групі головної підгрупи зростає зверху донизу Періодичної системи хімічних елементів.
Завдання 3 Напишіть електронні і графічні електронні формули елементів Флуору і Хлору
|
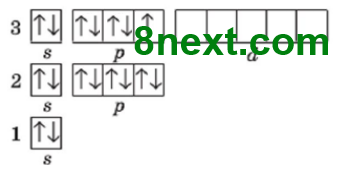
Флуор F 1s22s22p5
|
Хлор Cl 1s22s22p63s23p5
|
Поясніть подібність та відмінність у будові атомів і властивостях сполук.
Подібність: однакова будова зовнішнього енергетичного рівня атома: два s-електрони і п'ять р-електронів, є елементами VII групи головної підгрупи і мають подібні хімічні властивості. Їхніми гідратами є кислоти.
Відмінність: різне число енергетичних рівнів і радіус атома, здатність приєднувати електрони із зростанням заряду ядра атома послаблюється, хімічна активність елементів спадає. Флуор хімічно активніший, ніж Хлор.
Завдання 4 Напишіть рівняння реакцій взаємодії літію та водню з хлором і бромом. Поясніть, який з галогенів виявлятиме більшу хімічну активність.
|
2Li + Cl2 = 2LiCl |
2Li + Br2 = 2LiBr |
Хлор виявлятиме більшу хімічну активність. Галогени є елементами VII групи головної підгрупи, їх хімічна активність спадає зверху донизу Періодичної системи хімічних елементів.
ДОМАШНЄ ЗАВДАННЯ
І та II рівні
Вправа 1 Порівняйте будову атомів Силіцію і Сульфуру та поясніть, у якого з них слабше виявлені неметалічні властивості.
|
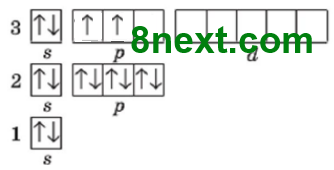
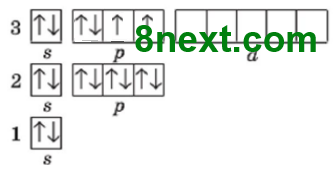
Силіцій Si 1s22s22p63s23p2
|
Сульфур S 1s22s22p63s23p4
|
Неметалічні властивості виявлені слабше у Силіцію.
Чим більше електронів на зовнішньому енергетичному рівні, тим атомам складніше їх віддавати, тому у періодах зліва направо Періодичної системи металічні властивості послаблюються, а неметалічні посилюються.
Вправа 2 Допишіть хімічні формули продуктів реакцій та перетворіть схеми на рівняння.
| № | І варіант | № | ІІ варіант |
| 1 |
Na2О + Н2О = 2NaOH |
1 |
Р2O5 + 3Н2O = 2H3PO4 |
| 2 |
2Мg + О2 = 2MgO |
2 |
4Аl + 3O2 = 2Al2O3 |
| 3 |
2Аl + 3Сl2 = 2AlCl3 |
3 |
Li2O + Н2O = 2LiOH |
Вправа 3 Обчисліть масову частку магнію у магній броміді.
Відомо: сполука MgBr3
Знайти: w(Mg)-?
Розв'язання
Mr(MgBr3)=Ar(Mg)+3•Ar(Br)=24+3•80=264
w(Mg)=Ar(Mg)/Mr(MgBr3)=24:264=0,09, або,
помноживши це значення на 100%, одержимо 9%
Відповідь: 0,09, або 9%
III та IV рівні
Вправа 4 Напишіть рівняння реакцій літію, натрію, калію з бромом. Поясніть, який з лужних металів виявляє більшу хімічну активність і чому.
| 2Li + Br2 = 2LiBr | 2Na + Br2 = 2NaBr | 2K + Br2 = 2KBr |
Більшу активність виявляє Калій.
У атомах лужних елементів по одному електрону, але вони розташовані на різних енергетичних рівнях. Чим далі від ядра розташовані валентні електрони, тим менше вони притягуються до ядра, завдяки цьому атоми Калію втрачають електрони легше, ніж Натрію, а Натрію легше, ніж Літію. Тобто, зі збільшенням радіуса атома валентні електрони втрачати легше, тому металічні властивості елементів у групах посилюються.
Вправа 5 Напишіть рівняння реакцій натрію, магнію, алюмінію з сіркою. Поясніть, як змінюється хімічна активність цих металів і чому. Вкажіть тип реакцій.
| 2Na + S = Na2S | Mg + S = MgS | 4Al + 6S = 2Al2S3 |
У атомах цих елементів є різна кількість валентних електронів на однаковому енергетичному рівні. Чим більше електронів на зовнішньому енергетичному рівні, тим атомам складніше їх віддавати, тому у періодах зліва направо Періодичної системи металічні властивості елементів послаблюються.
Тип реакцій ─ сполучення.
Вправа 6 Для виведення плям від іржі використовують розчин лимонної кислоти. Для цього у склянку з водою об'ємом 200 мл, нагрітою до 70°С, насипають кислоту масою 5 г і розмішують. Обчисліть масову частку кислоти у такому розчині.
Відомо: V(води)=200 мл; m(кислоти)=5 г.
Знайти: w(кислоти)-?
Розв'язування
І спосіб
1. Знаходимо масу води за формулою: m=V•ρ, де густина води ρ(води)=1 г/мл.
m(води)=200 мл • 1 г/мл=200 г. Бачимо, що для води об'єм відповідає масі, тому ця дія не є обов'язкова.
2. Знаходимо масу розчину.
m(розчину)=m(води)+m(кислоти)=200 г+5 г=205 г
3. Знаходимо масову частку речовини в розчині за формулою:
w(речовини)=(m(речовини)/m(розчину))•100%
w(кислоти)=(5 г : 205 г)•100%=0,0244•100%=2,44%
ІІ спосіб
1. Знаходимо масу води за формулою: m=V•ρ, де густина води ρ(води)=1 г/мл.
m(води)=200 мл • 1 г/мл=200 г. Бачимо, що для води об'єм відповідає масі, тому ця дія не є обов'язкова.
2. Знаходимо масу розчину.
m(розчину)=m(води)+m(кислоти)=200 г+5 г=205 г
3. Визначаємо масу речовини, що міститься у 100 г розчину, тобто, масову частку речовини. Для цього складаємо пропорцію і розв'язуємо її:
у 205 г розчину міститься 5 г кислоти
у 100 г розчину ─ х г кислоти
205 г / 100 г = 5 г / х г, тому х г • 205 г = 5 г • 100 г,
х=5 г • 100 г : 205 г=2,44 г, тому w(кислоти)=2,44%
Відповідь: w(кислоти)=2,44%, або 0,0244
Вправа 7 Насіння помідорів перед висівом обробляють розчином марганцівки (калій перманганату) з масовою часткою речовини 0,5%. Обчисліть, яку масу води та марганцівки треба взяти, щоб виготовити 150 г такого розчину.
Відомо: w=0,5 %, m(розчину)=150 г
Знайти: m(речовини)-? m(води)-?
І спосіб
1. Знаходимо масу речовини за формулою: m(речовини)=(m(розчину)•w)/100%.
m(речовини)=150 г • 0,5 % : 100%=0,75 г
2. Знаходимо масу води.
m(води)=m(розчину)-m(речовини)=150 г - 0,75 г=149,25 г
ІІ спосіб
1. Масова частка речовини в будь-якому розчині показує масу розчиненої речовини, що міститься у 100 г розчину, тому для визначення маси речовини у всьому розчині складаємо пропорцію і розв'язуємо її:
у 100 г розчину міститься 0,5 г калій перманганату,
у 150 г розчину ─ х г калій перманганату)
100 г / 150 г = 0,5 г / х г, тому х г • 100 г = 0,5 г • 150 г,
х=0,5 г • 150 г : 100 г=0,75 г, тому m(речовини)=0,75 г
2. Знаходимо масу води.
m(води)=m(розчину)-m(речовини)=150 г - 0,75 г=149,25 г
Відповідь: для виготовлення розчину марганцівки масою 150 г з масовою часткою калій перманганату 0,5% треба взяти марганцівки масою 0,75 г і воду масою 149,25 г.