![]()
САМОСТІЙНА РОБОТА (ФРОНТАЛЬНА)
Завдання 1 Охарактеризуйте, використовуючи періодичну систему, елементи із зарядами ядер:
1 варіант
| +3 |
+15 |
| +3, Літій, Ar(Li)=7 | +15, Фосфор, Ar(Р)=31 |
|
У 2 періоді, 2 ряді, головній підгрупі І групи |
У 3 періоді, 3 ряді, головній підгрупі V групи |
|
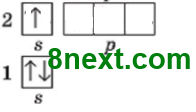
+3 )) 1s22s1 21
6-3=3 нейтрони На зовнішньому енергетичному рівні один неспарений s-електрон. Зовнішній рівень незавершений, бракує 7 електронів. |
+15 ))) 1s22s22р63s23р3 285
31-15=16 нейтронів На зовнішньому енергетичному рівні два спарені s-електрони і три неспарені р-електрони. Зовнішній рівень незавершений, бракує 3 електронів. |
| Метал лужний | Неметал |
| Li2O, валентність І, основний. | P2O5, валентність V, кислотний. |
|
LiOH ─ основа, розчинна у воді (луг). LiOH + HCl = LiCl + H2O |
Н3РО4 ─ кислота. Н3РО4 + 3NaOH = Na3PO4 + 3H2O |
|
Метали летких сполук з Гідрогеном не утворюють. |
РН3 ─ летка сполука з Гідрогеном, валентність Фосфору ІІІ. |
II варіант
| +11 |
+17 |
| +11, Натрій, Ar(Na)=23 | +17, Хлор, Ar(Cl)=35,5 |
|
У 3 періоді, 3 ряді, головній підгрупі І групи |
У 3 періоді, 3 ряді, головній підгрупі VII групи |
|
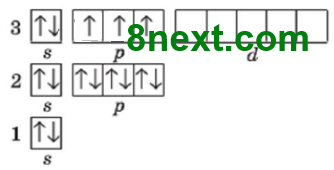
+11 ))) 1s22s22р63s1 281
23-11=12 нейтронів На зовнішньому енергетичному рівні один неспарений s-електрон. Зовнішній рівень незавершений, бракує 7 електронів. |
+15 ))) 1s22s22р63s23р5 287
35-15=15 нейтронів На зовнішньому енергетичному рівні шість спарених і один неспарений електрон. Зовніш- ній рівень незавершений, бракує 1 електрон. |
| Метал лужний | Неметал |
| Na2O, валентність І, основний. | Cl2O7, валентність VII, кислотний. |
|
NaOH ─ основа, розчинна у воді (луг). NaOH + HCl = NaCl + H2O |
НCl ─ кислота. НCl + NaOH = NaCl + H2O |
|
Метали летких сполук з Гідрогеном не утворюють. |
НCl ─ летка сполука з Гідрогеном, валентність Хлору І, кислота. |
Завдання 2 Передбачте за місцем у періодичній системі і будовою атома властивості елемента із зарядом ядра +19.
Заряд ядра атома дорівнює порядковому номеру елемента. Елементом з №19 є Калій, який розташований у 4 періоді, І групі головної підгрупи. На останньому енергетичному рівні атом містить один електрон, який легко віддає, тому елемент проявляє металічні властивості, його валентність І. Проста речовина метал калій, вищий оксид К2О ─ основний, гідрат оксиду КОН ─ основа, розчинна у воді (луг).
Завдання 3 Установіть відповідність між формулою оксиду, валентністю елемента в ньому та характером оксиду, відповідно:
|
A. NO В. К2О Г. Аl2O3 |
1. III 2. І 3. II 4. IV |
І. Основний
II. Амфотерний |
Несолетворними оксидами є ті, що не утворюють солей.
Відповідь:
| A | 3 | IV |
| Б | 4 | III |
| В | 2 | I |
| Г | 1 | II |
Завдання 4 Масова частка Оксигену у вищому оксиді елемента, що утворює летку сполуку з Гідрогеном складу НЕ, становить 61,2%. Обчисліть, який це елемент, напишіть формули сполук.
Відомо: летка сполука складу НЕ, w(O)=61,2%, або 0,612
Знайти: елемент Е-?
Розв'язування
Те, що елемент утворює летку сполуку з Гідрогеном складу НЕ, означає, що вища валентність елемента VII. (Пояснення: валентність елемента у леткій сполуці з Гідрогеном є різницею числа 8 і номера групи х, в якій розміщений елемент: 8-х=1, х=8-1, х=7, а номер групи, як правило, співпадає з вищою валентністю елемента). Тому вищий оксид елемента матиме вигляд Е2О7.
Відносну молекулярну масу сполуки знаходимо з формули обчислення масової частки елемента у сполуці:
w(елемента)=n•Ar(елемента)/Mr(сполуки)
w(О)=7•Ar(О)/Mr(Е2О7), звідси
Mr(Е2О7)=7•Ar(О)/w(О)=7•16:0,612=183
Відносну атомну масу елемента знаходимо з формули обчислення відносної молекулярної маси сполуки:
Mr(Е2О7)=2•Ar(Е)+7•Ar(О), звідси 2•Ar(Е)=Mr(Е2О7)-7•Ar(О), тому
Ar(Е)=(Mr(Е2О7)-7•Ar(О)):2=(183-7•16):2=35,5
Таку відносну атомну масу має елемент VII групи Хлор Сl
Летка сполука з Гідрогеном HCl
Вищий оксид Cl2O7
Відповідь: Хлор, HCl, Cl2O7
ДОМАШНЄ ЗАВДАННЯ
Вправа 1. Установіть відповідність між назвою, зарядом ядра та відносною атомною масою вказаних елементів:
| А. Натрій Б. Алюміній В. Магній Г. Кальцій |
1. +13 2. +12 3. +11 4. +20 |
І. 40 ІІ. 23 ІІІ. 27 IV. 24 |
Відповідь:
| А | 3 | II |
| Б | 1 | III |
| В | 2 | IV |
| Г | 4 | I |
Вправа 2. Установіть відповідність між фромулами, вищою валентністю елемента і формулами їх гідроксидів:
| A. SО3 Б. SiО2 B. Аl2О3 Г. К2О |
1. І 2. III 3. VI 4. IV |
I. Аl(ОН)3 IV. H2SO4 |
Відповідь:
| A. | 3 | IV |
| Б. | 4 | V |
| В. | 2 | I |
| Г. | 1 | II |
Вправа 3. Установіть відповідність між символами, зарядом ядра та будовою зовнішнього енергетичного рівня елементів:
|
A. Be Б. О B. P Г. Сl |
1. +15 2. +4 3. +17 4. +8 |
I. 3s23p5 III. 2s22p4 IV. 2s22p1 V. 2s2 |
Відповідь:
| A. | 2 | V |
| Б. | 4 | III |
| В. | 1 | II |
| Г. | 3 | I |
І та II рівні
Вправа 4 Масова частка Оксигену в оксиді двовалентного металу - 40%. Визначте метал, напишіть формулу оксиду.
Відомо: оксид двовалентного металу ЕО, w(О)=40%, або 0,4
Знайти: метал Е-?
Розв'язування
Відносну молекулярну масу сполуки знаходимо з формули обчислення масової частки елемента у сполуці:
w(елемента)=n•Ar(елемента)/Mr(сполуки)
w(О)=Ar(О)/Mr(ЕО), звідси Mr(ЕО)=Ar(О)/w(О)=16:0,4=40
Відносну атомну масу елемента знаходимо з формули обчислення відносної молекулярної маси сполуки:
Mr(ЕО)=Ar(Е)+Ar(О), звідси Ar(Е)=Mr(ЕО)-Ar(О)=40-16=24
Таку відносну атомну масу має елемент ІІ групи Магній Mg
Формула оксиду MgO
Відповідь: Магній, MgO
III рівень
Вправа 5 У оксиді п'ятивалентного елемента масова частка Оксигену становить 56,34%. Визначте, який це оксид та укажіть його характер.
Відомо: оксид п'ятивалентного елемента Е2О5, w(О)=56,34%, або 0,5634
Знайти: елемент Е-?
Розв'язування
Відносну молекулярну масу сполуки знаходимо з формули обчислення масової частки елемента у сполуці:
w(елемента)=n•Ar(елемента)/Mr(сполуки)
w(О)=5•Ar(О)/Mr(Е2О5), звідси
Mr(Е2О5)=5•Ar(О)/w(О)=5•16:0,5634=142
Відносну атомну масу елемента знаходимо з формули обчислення відносної молекулярної маси сполуки:
Mr(Е2О5)=2•Ar(Е)+5•Ar(О), звідси 2•Ar(Е)=Mr(Е2О5)-5•Ar(О), тому
Ar(Е)=(Mr(Е2О5)-5•Ar(О)):2=(142-5•16):2=31
Таку відносну атомну масу має елемент V групи Фосфор Р
Формула оксиду Р2O5 ─ кислотний оксид (бо йому відповідає кислота Н3РО4).
Відповідь: Фосфор, кислотний оксид Р2О5
IV рівень
Вправа б Елемент утворює летку сполуку з Гідрогеном складу Н2Е. З Оксигеном - два оксиди, в яких масова частка елемента становить, відповідно, 50% і 40%. Обчисліть, який це елемент, напишіть формули згаданих сполук і гідратів оксидів.
Відомо: летка сполука складу Н2Е; w(Е)=50%, або 0,5; w(Е)=40%, або 0,4
Знайти: елемент Е-?
Розв'язування
Те, що елемент утворює летку сполуку з Гідрогеном складу Н2Е, означає, що вища валентність елемента VI. (Пояснення: валентність елемента у леткій сполуці з Гідрогеном є різницею числа 8 і номера групи х, в якій розміщений елемент: 8-х=2, х=8-2, х=6, а номер групи, як правило, співпадає з вищою валентністю елемента). Тому вищий оксид елемента матиме вигляд ЕО3.
Відносну молекулярну масу сполуки знаходимо з формули обчислення масової частки елемента у сполуці:
w(елемента)=n•Ar(елемента)/Mr(сполуки)
w(Е)=Ar(Е)/Mr(ЕО3), звідси Mr(ЕО3)=Ar(Е)/w(Е)=Ar(Е)/0,5
Відносну атомну масу елемента знаходимо з формули обчислення відносної молекулярної маси сполуки:
w(Е)=Ar(Е)/Mr(ЕО3), звідси Mr(ЕО3)=Ar(Е)/w(Е)
Відносну атомну масу елемента знаходимо з формули обчислення відносної молекулярної маси сполуки:
Mr(ЕО3)=Ar(Е)+3•Ar(О), звідси
Ar(Е)=Mr(ЕО3)-3•Ar(О),
Ar(Е)=(Ar(Е)/w(Е))-3•Ar(О)
Ar(Е)•w(Е)=Ar(Е)-3•Ar(О)•w(Е)
Ar(Е)-Ar(Е)•w(Е)=3•Ar(О)•w(Е)
Ar(Е)(1-w(Е))=3•Ar(О)•w(Е)
Ar(Е)=(3•Ar(О)•w(Е))/(1-w(Е))
Розглянемо w(Е)=0,5, тоді відносна атомна маса елемента рівна
Ar(Е)=(3•16•0,5)/(1-0,5)=48
Елемент з відносною атомною масою 48 не є елементом VI групи.
Розглянемо w(Е)=0,4, тоді відносна атомна маса елемента рівна
Ar(Е)=(3•16•0,4)/(1-0,4)=32
Таку відносну атомну масу має елемент VI групи Сульфур S.
Сульфур утворює два оксиди: SO3 i SO2
Знайдемо масову частку Сульфуру в оксиді SO2 і переконаємось, що вона рівна 0,5.
w(S)=Ar(S)/Mr(SO2)=Ar(S)/(Аr(S)+2•Аr(O))=32/(32+2•16)=32:64=0,5
Отже, шуканий елемент Сульфур.
Формула гідрату сульфур (VI) оксиду SO3 ─ це Н2SO4 сульфатна кислота.
Формула гідрату сульфур (IV) оксиду SO2 ─ це H2SO3 сульфітна кислота.
Відповідь: Сульфур, SO3 і SO2, H2SO4 i H2SO3