![]()
| № |
Основні питання теми |
Відповіді |
| 1. |
Сформулюйте сучасне визначення періодичного закону. |
Властивості хімічних елементів та їх сполук перебувають у періодичній залежності від величини зарядів їх атомних ядер. |
| 2. |
Назвіть малі та великі періоди й кількість елементів у них. |
Малі - перший період містить 2 елементи, другий і третій - по 8 елементів. Великі - третій, четвертий і п'ятий період містять по 18 елементів, шостий і сьомий - по 32 елементи.
|
| 3. |
Сформулюйте визначення періоду. |
Період - горизонтальний рядок хіміч-
них елементів, розміщених у порядку зростання їх атомних мас, що почина- ється з Гідрогену або лужного металіч- ного елемента і закінчується інертним. |
| 4. |
Сформулюйте визначення груп та укажіть, до яких груп і підгруп належать лужні металічні та інертні елементи, галогени. |
Групи - це вертикальні стовпці хімічних елементів, подібних за властивостями. Лужні елементи належать до І групи головної підгрупи. Інертні елементи - до VIII групи головної підгрупи. Галогени - до VII групи головної підгрупи.
|
| 5. |
Поясніть фізич- ний зміст:
а) порядкового номера елемента; періоду; групи. |
а) порядковий номер хімічного елемента відповідає позитивному заряду ядра атома, тобто числу наявних в ньому протонів; б) число енергетичних рівнів дорівнює номеру періоду, в якому перебуває хімічний елемент; енергетичному рівні атома хімічного елемента дорівнює номеру групи, в якій перебуває елемент. |
| б. |
Поясніть закономірності періодів для: елементів; оксидів елементів: гідратів оксидів. |
а) за зростання заряду ядер атомів і зменшення радіуса, посилюється притягання ядром електронів зовніш- нього енергетичного рівня, власти- вість віддавати електрони послаблю- ється, а приєднувати посилюється, тому металічні властивості елементів послаблюються, а неметалічні поси- люються. б) зростає вища валентність за Оксиге- ном від І до VII, характер оксидів змінюється від основних через амфо- терні до кислотних. в) послаблюється сила основ, посилю- ються кислотні властивості. |
| 7. |
Поясніть закономірності головних підгруп для: елементів; оксидів елементів: гідратів оксидів. |
а) зростає радіус атома, послаблюється зв'язок з зовнішнім енергетичним рівнем, здатність віддавати електрони зростає - хімічна активність металічних елементів посилюється, а здатність приєднувати електрони спадає - хімічна активність неметалічних елементів послаблюється; б) хімічна активність оксидів металічних елементів зростає, а оксидів неметаліч- них елементів спадає; в) хімічна активність основ посилюється, а кислот послаблюється. |
| 8. |
Поясніть будову атомів (ядра - кількість протонів й нейтронів та електронних оболонок - розподіл електронів за енергетичними рівнями) хімічних елементів на прикладі: елементів; |
а) ядра та електронної оболонки Na: протонів 11, нейтронів 12 (23-11=12), електронів 11 Na +11 ))) 281 протонів 17, нейтронів 18 (35-17=18), електронів 17 Cl +17 ))) 287 в) ядра та електронної оболонки Ne: протонів 10, нейтронів 10 (20-10=10), електронів 10 Ne +11 ))) 288 |
| 9. |
На основі будови атомів, зробіть висновки про хімічну активність і причину цієї активності для: елементів; |
а) висока хімічна активність зумовлена появою нового енергетичного рівня з найменшою кількістю електронів (один); що до завершення зовнішнього енерге- тичного рівня бракує найменшого числа електронів (одного).
|
| 10. |
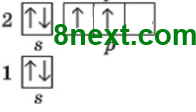
Поясніть на конкретному прикладі, що показує графічна електронна формула. |
Графічна електронна оболока атома Карбону показує розподіл електронів за енергетичними комірками:
|
| 11. |
висновок про значення періодичного закону для розвитку науки. |
а) вказав шлях до створення таблиці класифікації хімічних елементів (Періодичної системи); б) дав можливість прогнозувати існування ще невідомих науці хімічних елементів; в) дав поштовх до розвитку теорії будови атома, створення моделей атома; г) світоглядне значення, підтвердження існування об'єктивних законів природи: закон єдності та боротьби протилеж- ностей, закон заперечення заперечення, закон переходу кількісних змін у якісні тощо. |