![]()
І рівень
Завдання 1 Позначте заряд ядра атома Купруму:
| А. +29 | Б. +30 |
В. +27 |
Г. +37 |
Заряд ядра атома = порядковий номер елемента.
Завдання 2 Позначте число електронів у електронних оболонках атомів Літію і Хлору, відповідно:
| А. 7 і 35 |
Б. 35,5 і 17 | В. З і 17 | Г. 35 і 7 |
Число електронів = числу протонів = порядковому номеру елемента.
Завдання 3 Позначте елемент із завершеним зовнішнім енергетичним рівнем:
| А. Карбон |
Б. Флуор |
В. Магній |
Г. Аргон |
Завершений зовнішній енергетичний рівень мають інертні елементи.
Завдання 4 Укажіть елементи другого періоду, двовалентні у вищому оксиді:
| A. Na |
Б. Be |
В. Mg |
Г. В |
Максимальне значення валентності хімічних елементів головних підгруп у сполуках з Оксигеном збігається з номером групи, в якій розміщений елемент.
Завдання 5 Укажіть елемент, який утворює летку сполуку з Гідрогеном:
| А. Силіцій | Б. Берилій | В. Бор | Г. Натрій |
Леткі сполуки з Гідрогеном утворюють неметалічні елементи.
Завдання 6 Укажіть фізичний зміст номера періоду:
A. Вказує на заряд ядра атома.
Б. Визначає число валентних електронів.
B. Показує число енергетичних рівнів в атомі.
Г. Визначає число електронів на зовнішньому рівні.
Завдання 7 Установіть послідовність розміщення елементів у періоді з посиленням їх неметалічних властивостей:
| А. О |
Б. Be | B. N | Г. С |
Відповідь: БГВА
У періоді неметалічні властивості елементів посилюються зліва направо Періодичної системи.
Завдання 8 Установіть послідовність розміщення елементів у підгрупі із зростанням їх металічних властивостей:
| А. Мg |
Б. Вe |
В. Са |
Г. Sr |
Відповідь: БАВГ
У підгрупі металічні властивості елементів посилюються зверху донизу Періодичної системи.
II рівень
Завдання 1 Установіть послідовність розміщення елементів у періоді з посиленням їх металічних властивостей:
| A. Si | Б. Мg |
В. Аl | Г. Na |
Відповідь: АВБГ
У періоді металічні властивості елементів послаблюються зліва направо Періодичної системи.
Завдання 2 Установіть послідовність розміщення елементів у підгрупі із зростанням їх неметалічних властивостей:
| A. Se |
Б. О |
В.Те |
Г. S |
Відповідь: ВАГБ
У підгрупі неметалічні властивості елементів посилюються знизу доверху Періодичної системи.
Завдання 3 Установіть відповідність (позначено однаковим кольором):
|
Назва елемента |
Заряд ядра атома |
|
А. Натрій Б. Бром |
1. +35 2. +373. +11 |
Заряд ядра атома = порядковий номер елемента.
Завдання 4 Укажіть два елементи, які утворюють вищі оксиди складу RO:
| A. Be |
Б. Na |
В. Ва |
Г. В |
Максимальне значення валентності хімічних елементів головних підгруп у сполуках з Оксигеном збігається з номером групи, в якій вони розміщені. У формулі RO валентність елемента R рівна ІІ. Be i Вa є елементами ІІ групи.
Завдання 5 Укажіть два елементи, які утворюють леткі сполуки з Гідрогеном складу Н2Е:
| А. Хлор |
Б. Сульфур |
В. Бром. Г |
Г. Оксиген |
Значення валентності неметалічних елементів у сполуках з Гідрогеном становить різницю між числом 8 і номером групи х, в якій розміщений елемент, тому 8-х=2, х=8-2=6. Елементами VI групи головної підгрупи є Сульфур і Оксиген.
Завдання 6 Установіть відповідність (позначено однаковим кольором):
| Назва елемента | Номер періоду |
| А. Алюміній Б. Арсен |
1. 2 2. 4 3. 3 |
Завдання 7 Позначте, як змінюються властивості елементів на проміжку С—N—О:
A. Плавно посилюються металічні.
Б. Стрибкоподібно.
B. Послаблюються неметалічні.
Г. Плавно посилюються неметалічні.
Завдання 8 Укажіть елементи однієї підгрупи за їх протонними числами:
| А. 5,6,7 |
Б. 4,12,20 | В. 8,9,10 |
Г. 14,22,32 |
Bе, Mg, Ca
Завдання 9 Охарактеризуйте елемент 14 за місцем у періодичній системі і будовою атома використовуючи алгоритм в робочому зошиті.
| Порядковий номер елемента 14 |
| +14, Силіцій, Ar(S)=28 |
|
У 3 періоді, 3 ряді, головній підгрупі IV групи |
|
+14 ))) 1s22s22р63s23р2 284
28-14=14 нейтронів На зовнішньому енергетичному рівні два спарені s-електрони і два неспарені р-електрони. Зовнішній рівень незавершений, бракує 4 електронів. |
| Неметал |
| SiO2, валентність IV, кислотний. |
|
Н2SiО3 — кислота. |
|
SiН4 — летка сполука з Гідрогеном, валентність IV. |
Завдання 10 Масова частка Оксигену в оксиді двовалентного металу — 28,6%. Який це метал?
| А. Сг |
Б. Ва | В. Са | Г. Fe |
Дано: оксид двовалентного металу ЕО, w(О)=28,6%, або 0,286
Знайти: метал Е-?
Розв'язування
Відносну молекулярну масу сполуки знаходимо з формули масової частки елемента у сполуці: w(О)=Ar(О)/Mr(ЕО), звідси Mr(ЕО)=Ar(О)/w(О)=16:0,286=56
Відносну атомну масу елемента знаходимо з формули обчислення відносної молекулярної маси сполуки: Mr(ЕО)=Ar(Е)+Ar(О), звідси Ar(Е)=Mr(ЕО)-Ar(О)=56-16=40.
Таку відносну атомну масу має двовалентний метал — кальцій Са.
III та IV рівні
Завдання 1 Позначте, як змінюються властивості елементів від Не до Li:
A. Плавно посилюються металічні
Б. Стрибкоподібно
B. Послаблюються неметалічні
Г. Плавно посилюються неметалічні
На проміжку інертний газ (Не) — лужний металічний елемент (Li) спостерігається різка (стрибкоподібна) зміна властивостей, бо в інертного елемента завершений рівень має 8 електронів, а в лужного металічного елемента з'являється новий енергетичний рівень, віддалений від ядра, порівняно з попереднім.
Завдання 2 Укажіть ряд елементів, у якому вони розміщені в порядку зростання зарядів ядер атомів:
| A. Si, Р, S |
Б. С, Si, Ge |
В. В, С, Si |
Г. F, CI, Mn |
Заряд ядра атома = порядковий номер елемента
Завдання 3 Позначте, як змінюються властивості елементів на проміжку Li—Na—К:
A. Посилюються неметалічні
Б. Послаблюються неметалічні
B. Посилюються металічні
Г. Послаблюються металічні
У головних підгрупах металічні властивості елементів посилюються зверху донизу Періодичної системи.
Завдання 4. Установіть відповідність (позначено однаковим кольором):
| Назва елемента | Заряд ядра атома |
| А. Кальцій Б. Цинк |
1.+19 2.+30 3. +20 |
Заряд ядра атома = порядковий номер елемента.
Завдання 5. Установіть послідовність розміщення елементів у підгрупі із послабленням неметалічних властивостей:
| А. Cl |
Б. F |
В. І |
Г. Вг |
Відповідь: БАГВ
У підгрупі неметалічні властивості елементів посилюються знизу доверху Періодичної системи.
Завдання 6. Установіть відповідність (позначено однаковим кольором):
| Елемент | Період | Підгрупа, група |
| А. Алюміній Б. Ферум |
1. 4 2. 3 3. 2 |
І. Головна підгрупа VIII групи II. Головна підгрупа III групи III. Побічна підгрупа III групи IV. Побічна підгрупа VIII групи |
Завдання 7 Позначте два елементи, що мають таку електронну конфігурацію:
1s22s22p63s23p1 і 1s22s22p63s23p64s2:
| A. Si, Сl |
Б. Аl, Са |
В. Мg, Аl |
Г. Са, Sc |
Перша електронна конфігурація належить атому, що містить три енергетичні рівні, тому елемент розташований у 3 періоді, і на його останньому рівні міститься 3 електрони (2 s- і 1 р-електрон), тому елемент розташований у ІІІ групі головній підгрупі — це Алюміній Al.
Друга електронна конфігурація належить атому, що містить чотири енергетичні рівні, тому елемент розташований у 4 періоді, і на його останньому рівні міститься 2 s-електрони, тому елемент розташований у ІІ групі головної підгрупи — це Кальцій Са.
Завдання 8 Позначте загальні формули кислот, утворених оксидом складу Е2О5:
| А. НЕО3 |
Б. НЕО4 |
В. Н2ЕО3 |
Г. Н3ЕО4 |
Валентність елемента у оксиді V, тому у кислотах валентність елемента теж повинна дорівнювати п'яти.
Валентність Гідрогену та Оксигену постійна і дорівнює відповідно І і ІІ.
Позначимо валентність Е через х, тоді у кислоті НІЕхО3ІІ: 1+х=3•2, звідси х=5
Позначимо валентність Е через х, тоді у кислоті НІЕхО4ІІ: 1+х=4•2, звідси х=7
Позначимо валентність Е через х, тоді у кислоті Н2ІЕхО3ІІ: 2•1+х=3•2, звідси х=4
Позначимо валентність Е через х, тоді у кислоті Н3ІЕхО4ІІ: 3•1+х=4•2, звідси х=5
Завдання 9 Позначте загальну формулу кислоти, основний елемент якої утворює летку сполуку з Гідрогеном складу Н2Е:
| А. Н2ЕО3 |
Б. НЕО4 |
В. Н2ЕО4 |
Г. Н3ЕО4 |
Значення валентності неметалічних елементів у сполуках з Гідрогеном становить різницю між числом 8 і номером групи х, в якій розміщений елемент, тому 8-х=2, х=8-2=6, отже, це елемент VI групи головної підгрупи, тому його валентність у кислоті повинна дорівнювати VI. Як визначити валентність Е у кислоті, дивись вправу вище (завдання 8).
Завдання 10 Охарактеризуйте, за місцем у періодичній системі і будовою атома, елемент з електронною формулою 1s22s22p63s23p3. Напишіть схему розташування електронів за енергетичними комірками.
Таку електронну конфігурацію має елемент розташований у третьому періоді (число енергетичних рівнів атома 3) у п'ятій групі (атом містить п'ять валентних електронів: два s- і три р-) головній підгрупі (наявні тільки р- і s-орбіталі). Порядковий номер елемента 15 (2+2+6+2+3=15), символ хімічного елемента Р, назва Фосфор, проста речовина фосфор, заряд ядра атома +15, загальне число електронів 15, Ar(P)=31, число нейтронів 31-15=16.
+15 )))
285
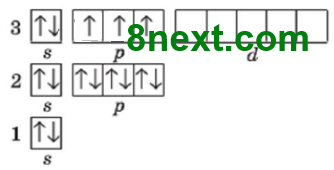
На зовнішньому енергетичному рівні три неспарені р-електрони, зовнішній рівень незавершений, бракує 3 електронів. Неметал. Оксид P2O5, валентність V, кислотний. Гідрат оксиду Н3РО4 — кислота.
Н3РО4 + 3NaOH = Na3PO4 + 3H2O
РН3 — летка сполука з Гідрогеном, валентність Фосфора ІІІ.
Завдання 11 Відносна молекулярна маса леткої сполуки елемента з Гідрогеном у 17 разів важча за відносну молекулярну масу водню. Масова частка Гідрогену в ній — 8,83%. Знайдіть формулу сполуки. Напишіть формули вищого оксиду та гідрату оксиду елемента, що входить до її складу, вкажіть їх характер.
Оскільки валентність Гідргену у леткій сполуці завжди дорівнює 1, то в загальному випадку формулу леткої сполуки можна записати у вигляді ЕНх.
Відомо: Mr(ЕНх)/Mr(Н2)=17, w(Н)=8,83%, або 0,0883
Знайти: формулу ЕНх -?
Розв'язання
Mr(ЕНх)/Mr(Н2)=17, звідси Mr(ЕНх)=17•Mr(Н2)=17•2•Аr(Н)=17•2•1=34
Кількість атомів кожного елемента у сполуці знаходимо з формули обчислення масової частки елемента у сполуці.
x(Н)=w(Н)•Мr(ЕНх):Аr(Н)=0,0883•34:1=3
Отже, формула сполуки ЕН3.
Відносну атомну масу невідомого елемента знаходимо з формули обчислення відносної молекулярної маси сполуки:
Mr(ЕН3)=Ar(E)+3•Ar(H), звідси Ar(E)=Mr(ЕН3)-3•Ar(H)=34-3•1=31
Таку відносну атомну масу має елемент V групи Фосфор, отже, формула леткої сполуки РН3.
(Пояснення: те, що елемент утворює летку сполуку з Гідрогеном складу ЕН3, означає, що елемент міститься у V групі, бо валентність елемента у леткій сполуці з Гідрогеном є різницею числа 8 і номера групи х, в якій розміщений елемент: 8-х=3, х=8-3=5).
Максимальне значення валентності хімічних елементів головних підгруп у сполуках з Оксигеном збігається з номером групи, в якій вони перебувають, тому формула вищого оксиду Р2О5. Характер кислотний, бо йому відповідає гідрат оксиду — кислота Н3РО4.
Відповідь: РН3, Р2О5 — кислотний, H3PO4 — кислота.
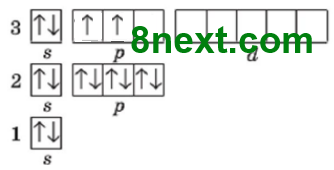
Завдання 12. Оберіть елемент періодичної системи, який має такий розподіл електронів на зовнішньому енергетичному рівні: ns2np3. Охарактеризуйте його за місцем у періодичній системі і будовою атома.
Це елемент V групи (атом містить п'ять валентних електронів: два s- і три р-). Оберемо Нітроген N.
| Порядковий номер елемента 7 |
| +7, Нітроген, Ar(N)=14 |
|
У 2 періоді, у 2 ряді, головній підгрупі V групи |
|
+7 )) 1s22s22p3 25
14-7=7 нейтронів На зовнішньому енергетичному рівні три неспарені р-електрони. Зовнішній рівень незавершений, бракує 3 електронів. |
| Неметал |
|
Вищий оксид N2O5, валентність V, кислотний. |
|
НNО3 — кислота. НNO3 + NaOH = NaNO3 + H2O |
|
NН3 — летка сполука з Гідрогеном, валентність Нітрогену ІІІ. |
Ill та IV рівні
Завдання 13. Елемент утворює вищий оксид складу Е2О5. Масова частка елемента у леткій сполуці з Гідрогеном становить 91,18%. Визначте, який це елемент та обчисліть масову частку Оксигену у вищому оксиді. Напишіть формулу гідрату оксиду й укажіть його характер.
Відомо: вищий оксид складу Е2О5, w(Е)=91,18%, або 0,9118
Знайти: елемент Е -?; w(О)-?
(Пояснення: валентність елемента у вищому оксиді складу Е2О5 дорівнює V і збігається з номером групи, в якій розміщений елемент. Валентність елемента у леткій сполуці з Гідрогеном є різницею числа 8 і номера групи, в якій розміщений елемент, тому 8-5=3, отже, летка сполука матиме вигляд ЕН3).
Розв'язання:
1. Визначимо, який це елемент.
І спосіб
Обчислимо масову частку Гідрогену у леткій сполуці:
w(Н)=1-w(Е)=1-0,9118=0,0882
Відносну молекулярну масу леткої сполуки знаходимо з формули обчислення масової частки елемента у сполуці.
w(Н)=3•Ar(Н)/Mr(ЕН3), звідси Mr(ЕН3)=3•Ar(Н)/w(Н)=3•1:0,0882=34
Відносну атомну масу елемента знаходимо з формули обчислення відносної молекулярної маси сполуки:
Mr(ЕН3)=Ar(Е)+3•Ar(Н), звідси Ar(Е)=Mr(ЕН3)-3•Ar(Н)=34-3•1=31
Таку відносну атомну масу має елемент V групи Фосфор Р.
ІІ спосіб
Відносну молекулярну масу сполуки знаходимо з формули обчислення масової частки елемента у сполуці:
w(Е)=Ar(Е)/Mr(ЕН3), звідси Mr(ЕН3)=Ar(Е)/w(Е).
Відносну атомну масу елемента знаходимо з формули обчислення відносної молекулярної маси сполуки:
Mr(ЕН3)=Ar(Е)+3•Ar(Н), звідси
Ar(Е)=Mr(ЕН3)-3•Ar(Н)
Ar(Е)=(Ar(Е)/w(Е))-3•Ar(Н)
Ar(Е)•w(Е)=Ar(Е)-3•Ar(Н)•w(Е)
Ar(Е)-Ar(Е)•w(Е)=3•Ar(Н)•w(Е)
Ar(Е)•(1-w(Е))=3•Ar(Н)•w(Е)
Ar(Е)=3•Ar(Н)•w(Е)/(1-w(Е))
Підставивши значення, отримаємо
Ar(Е)=3•1•0,9118/(1-0,9118)=2,7354:(1-0,9118)=2,7354:0,0882=31
Таку відносну атомну масу має елемент V групи Фосфор Р.
2. Знайдемо масову частку Оксигену у вищому оксиді Р2О5.
Mr(Р2O5)=2•Аr(Р)+5•Аr(O)=2•31+5•16=142
w(О)=5•Ar(О)/Mr(Р2O5)=5•16:142=0,563, або 56,3%
Формула гідрату оксиду Н3РO4 — ортофосфатна кислота.
Відповідь: Фосфор Р, ω(О)=0,563, або 56,3%, H3РO4 — кислота.