Завдання 1 Молекулярна формула карбонової кислоти та естеру – С3Н6О2. У цих речовин
А однакова хімічна будова
Б однакова молекулярна маса
В однакові температури кипіння
Г однакові хімічні властивості
Завдання 2 На якому з рисунків схематично зображено суміш молекул простих речовин одного хімічного елемента?
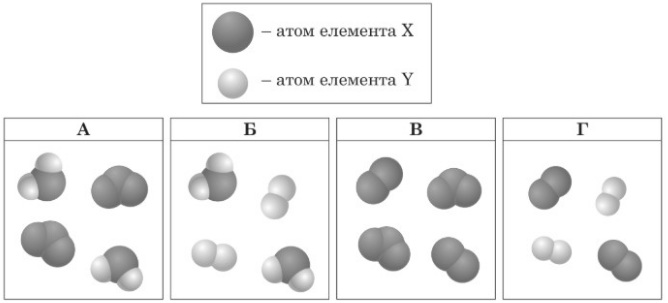
А Б В Г
Завдання 3 Проаналізуйте наведену в таблиці інформацію щодо складу ядер атомів.
|
Кількість протонів |
Кількість нейтронів |
| 7 | 8 |
| 8 | 8 |
| 8 | 10 |
| 9 | 10 |
| 10 | 12 |
Склад ядер атомів скількох хімічних елементів описано?
А двох
Б трьох
В чотирьох
Г п’ятьох
Пояснення.
Кількість протонів = порядковий номер хімічного елемента.
Завдання 4 Однакова кількість нейтронів в атомах, нуклідні символи яких наведено в рядку
| А | 8838Sr | 8636Kr |
| Б | 4020Cs | 4018Ar |
| В | 7935Br | 8135Br |
| Г | 2210Ne | 2914Si |
А Б В Г
Пояснення.
А 88-38=50 і 86-36=50
Завдання 5 Укажіть кількість електронів у йоні, нуклідний символ якого 3517Cl–.
А 36
Б 34
В 18
Г 16
Пояснення.
Йон Сl- - це атом, який приєднав 1 електрон, тому 17+1=18
Завдання 6 Визначте ступінь окиснення Брому в речовині, формула якої NaBrO3.
А +1
Б +3
В +5
Г +7
Пояснення.
У сполуці NaBrO3 ступінь окиснення Na(+1), O(-2). Позначимо ступінь окиснення Брому у сполуці через х: Na+BrхO3-2, тоді за властивістю електронейтральності 1•1+1•x+3•(-2)=0, 1+x-6=0, х=5, отже, ступінь окиснення Br(+5)
Завдання 7 Формули йонних сполук записано в рядку
А H2S, CS2, SO2
Б P4S6, PH3, P4O10
В CBr4, CH4, CO2
Г Na2O, NaCl, NaF
Завдання 8 Проаналізуйте рівняння оборотної реакції, яка перебуває в стані хімічної рівноваги й відбувається в закритій системі:
СО (г) + 2H2 (г) ⇄ СН3ОН (г), ΔН<0
Зміщення хімічної рівноваги в бік утворення метанолу зумовить кожна з наведених змін:
1 зниження тиску
2 підвищення тиску
3 зниження температури
4 підвищення температури
Варіанти відповіді:
А 1, 3
Б 1, 4
В 2, 3
Г 2, 4
Пояснення.
Реакція утворення метанолу є екзотермічною, а охолодження (зниження температури) рівноважної суміші зміщує рівновагу в бік екзотермічної реакції. Підвищення тиску зміщує рівновагу в бік зменшення числа молекул газів: 3 → 1
Завдання 9 Проаналізуйте рівняння оборотних реакцій, які відбуваються в закритих системах. Зниження тиску зумовить зміщення хімічної рівноваги ПРАВОРУЧ реакції, рівняння якої
А 2SO2 (г) + O2 (г) ⇄ 2SO3 (г)
Б N2 (г) + 3H2 (г) ⇄ 2NH3 (г)
В CO2 (г) + C (т) ⇄ 2CO (г)
Г 3O2 (г) ⇄ 2O3 (г)
Пояснення.
Зниження тиску зміщує рівновагу в бік збільшення числа молекул газів (А 3 ← 2, Б 4 ← 2, Г 3 ← 2), тобто зумовить зміщення хімічної рівноваги у цих рівняннях ЛІВОРУЧ. Зміна тиску не впливає на стан рівноваги реакцій, в яких число молекул газуватих речовин до реакції і після реакції не змінюється.
Завдання 10 Проаналізуйте наведену схему гальванічного елемента.
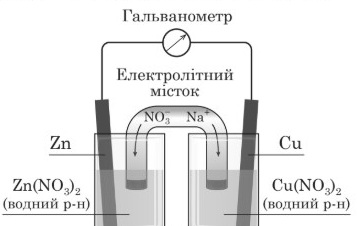
Укажіть ПОМИЛКОВЕ твердження щодо його роботи.
А На цинковому електроді катіони Zn2+ відновлюються.
Б На мідному електроді катіони Cu2+ відновлюються.
В Маса цинкового електрода поступово зменшується.
Г Маса мідного електрода поступово збільшується.
Завдання 11 Укажіть символ хімічного елемента E в речовині, формула якої Na[E(OH)4].
А Al
Б Mg
В Li
Г Zn
Завдання 12 Яка із солей у водному розчині гідролізує як за катіоном, так і за аніоном?
А алюміній хлорид
Б амоній карбонат
В амоній сульфат
Г натрій сульфід
Пояснення.
А. Сіль алюміній хлорид утворена слабкою основою і сильною кислотою, тому гідролізує за катіоном.
Б Сіль амоній карбонат утворена слабкою основою і слабкою кислотою, тому гідролізує як за катіоном, так і за аніоном.
В. Сіль амоній сульфат утворена слабкою основою і сильною кислотою, тому гідролізує за катіоном.
Г. Сіль натрій сульфід утворена сильною основою і слабкою кислотою, тому гідролізує за аніоном.
Завдання 13 Осадити катіони Fe3+ з водного розчину ферум (ІІІ) хлориду можна за допомогою водного розчину
А аргентум (І) нітрату
Б натрій гідроксиду
В натрій сульфату
Г барій нітрату
Пояснення.
Б Якісною реакцією на катіони Fe3+ є гідроксид-аніони ОН-, що містяться, наприклад, в натрій гідроксиді NaOH
Завдання 14 Формули солей, для кожної з яких правильно зазначено середовище її водного розчину, наведено в рядку
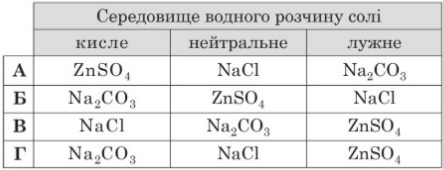
А Б В Г
Пояснення.
А Сіль ZnSO4 утворена слабкою основою і сильною кислотою, тому гідролізує за катіоном (кисле), NaCl - сильною основою і сильною кислотою, тому не гідролізує (нейтральне), а Na2CO3 - сильною основою і слабкою кислотою, тому гідролізує за аніоном (лужне).
Завдання 15 Є два водні розчини солей:
1 – натрій сульфіду Na2S;
2 – амоній нітрату NH4NO3.
Проаналізуйте наведені твердження.
І. Для визначення середовища розчину 1 можна використати водно-спиртовий розчин фенолфталеїну.
ІІ. Значення pH розчину 2 менше, ніж значення pH розчину 1.
Чи є поміж них правильні?
А правильне лише І
Б правильне лише ІІ
В обидва правильні
Г немає правильних
Пояснення.
1 - сіль натрій сульфіду Na2S утворена сильною основою і слабкою кислотою, тому гідролізує за аніоном (лужне середовище, pH>7, фенолфталеїн змінює забарвлення).
2 - сіль амоній нітрату NH4NO3 утворена слабкою основою і сильною кислотою, тому гідролізує за катіоном (кисле cередовище, pH<7, фенолфталеїн не змінює забарвлення).
Завдання 16 У водний розчин плюмбум (ІІ) етаноату занурили пластинки, виготовлені з металів X та Y (див. рисунок). Відомо, що одним з металів був кадмій, а іншим – мідь. Згодом пластинки вийняли, висушили й зважили. Змінилася лише маса пластинки, виготовленої з металу X.
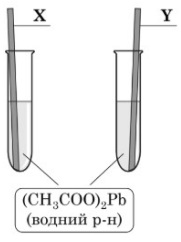
Проаналізуйте наведені твердження.
І. Маса пластинки, виготовленої з металу X, зменшилася.
ІІ. Метал Y, з якого виготовлено пластинку, – мідь.
Чи є поміж них правильні?
А правильне лише І
Б правильне лише ІІ
В обидва правильні
Г немає правильних
Пояснення.
Збільшилася маса пластинки Х, виготовленої з кадмію, а не змінилася маса пластинки Y, виготовленої з міді. Кадмій розташований в ряді активності металів лівіше від плюмбума, а мідь - правіше, тому кадмій витіснить плюмбум з розчину його солі, а мідь - ні.
Завдання 17 З водного розчину цинк не відновлює катіони
А Cu2+
Б Mg2+
В Ag+
Г H+
Пояснення.
Цинк є менш активним металом, ніж магній, бо в ряді активності металів розташований правіше від магнію.
Завдання 18 Є чотири пробірки з розчинами, що утворилися внаслідок змішування з водою таких речовин: 1 – сульфур (IV) оксиду, 2 – амоніаку, 3 – амоній хлориду, 4 – кальцій оксиду. У кожну з чотирьох пробірок добавили кілька крапель водно-спиртового розчину фенолфталеїну.
Укажіть пару пробірок, у яких індикатор набув малинового кольору.
А 1, 3
Б 1, 4
В 2, 3
Г 2, 4
Пояснення.
1. SO2 + H2O = H2SO3 кислотне середовище
2. NH3 + H2O ⇄ NH4++OH- лужне середовище (фенолфталеїн малиновий)
3. Розчин солі NH4Cl гідролізує за катіоном, кислотне середовище
4. СаО + Н2О = Са(ОН)2 лужне середовище (фенолфталеїн малиновий)
Завдання 19 У таблиці наведено формули гідроксидів 1–4.
| 1 | 2 | 3 | 4 |
| NaOH | Al(OH)3 | Ca(OH)2 | Zn(OH)2 |
З-поміж них амфотерні властивості виявляють лише
А 1 та 3
Б 2 та 4
В 3 та 4
Г 2, 3 та 4
Завдання 20 Водний розчин речовини Х розділили на дві пробірки. У першу добавили водний розчин барій нітрату, а в другу – водний розчин натрій гідроксиду. Унаслідок цього в обох пробірках спостерігали утворення осаду. Речовина Х – це
А магній сульфат
Б магній хлорид
В калій сульфат
Г калій хлорид
Пояснення
A. MgSO4 + Ba(NO3)2 = Mg(NO3)2 + BaSO4↓
MgSO4 + 2NaOH = Na2SO4 + Mg(OH)2↓
Завдання 21 Газуваті азот та карбон (IV) оксид можна розрізнити за допомогою
А фільтрувального паперу, змоченого розчином фенолфталеїну
Б водного розчину калій перманганату
В вапняної води
Г бромної води
Пояснення
Якісною реакцією на СО2 є помутніння вапняної води Са(ОН)2 з подальшим зникненням каламуті:
Сa(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3↓ + CO2 + H2O = Ca(HCO3)2 - розчинна сіль
Завдання 22 Укажіть формулу органічної речовини.
А H2O2
Б СaH2
В P4O10
Г C4H10
Завдання 23 Укажіть назву за номенклатурою IUPAC речовини, структурну формулу якої наведено.
|
СН3 | Н3С—СН—СН—ОН | СН3 |
А 1,2-диметилпропан-1-ол
Б 2,3-диметилпропан-3-ол
В 2-метилбутан-3-ол
Г 3-метилбутан-2-ол
Пояснення.
|
ОН | Н3С—СН—СН—СН3 | СН3 |
Завдання 24 Проаналізуйте наведені в таблиці дані щодо температур кипіння та плавлення альдегідів А – Г за тиску 105 Па. Який з альдегідів за такого тиску й температури –90°C перебуватиме у твердому стані?
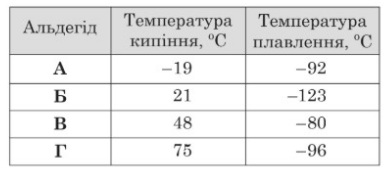
А Б В Г
Пояснення.
- 123 < -96 < -92 < -90 < -80, температура середовища є нижчою, ніж температура плавлення альдегіду Б.
Завдання 25 Проаналізуйте твердження щодо речовини, структурну формулу якої наведено.
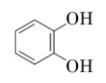
І. Речовина належить до ароматичних двохатомних спиртів.
ІІ. Найпростіша формула речовини С3Н3О.
Чи є поміж них правильні?
А правильне лише І
Б правильне лише ІІ
В обидва правильні
Г немає правильних
Пояснення.
Формула фенолу С6Н6О2
x:y:z=6:6:2=3:3:1
Завдання 26 Назви структурних ізомерів наведено в рядку
А пропан і циклопропан
Б бутан і 2-метилбутан
В бут-1-ен і бут-2-ен
Г пропен і пропан
Пояснення.
А С3H8 i C3H6
Б C4H10 i C5H12
В C4H8 i C4H8 - однакові молекулярні формули
Г C3H6 i C3H8
Завдання 27 Продуктом міжмолекулярної дегідратації етанолу є речовина, формула якої

А Б В Г
Пояснення.
Б C2H5OH + HO―C2H5 → С2H5―O―C2H5 + H2O
Завдання 28 ПОМИЛКОВЕ твердження наведено в рядку
А Бензен реагує з хлором за наявності каталізатора.
Б Бензен реагує з хлором за освітлення.
В Бензен реагує з бромною водою.
Г Фенол реагує з бромною водою.
Пояснення.
В Бензен реагує з бромною водою за наявності каталізатора.
Завдання 29 Проаналізуйте твердження.
І. Бензен належить до вуглеводнів циклічної будови.
ІІ. Бензен і циклогексан є структурними ізомерами.
Чи є поміж них правильні?
А правильне лише І
Б правильне лише ІІ
В обидва правильні
Г немає правильних
Пояснення.
Молекулярна формула бензену С6Н6, а циклогексану С6Н12, тому не є ізомерами.
Завдання 30 Укажіть структурну формулу триатомного спирту.
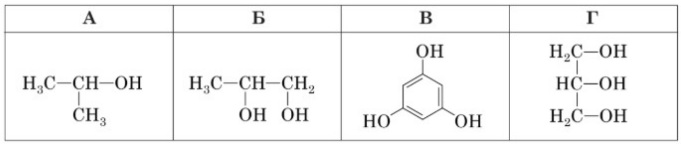
А Б В Г
Пояснення.
А. формула одноатомного спирту
Б. Формула двохатомного спирту
В. Формула триатомного фенолу
Г. фомула триатомного спирту
Завдання 31 До водного розчину натрій гідроксиду добавили кілька крапель водного розчину купрум (ІІ) сульфату. До осаду, що утворився, долили водний розчин речовини Х. Після перемішування реакційної суміші утворився прозорий розчин темно-синього кольору.
Речовина Х – це
А пропан-1,2-діол
Б пропан-2-ол
В пропан-1-ол
Г пропаналь
Пояснення.
А. Якісна реакція на багатоатомні спирти.
Завдання 32 До полісахаридів належить як
А сахароза, так і фруктоза
Б крохмаль, так і глюкоза
В сахароза, так і целюлоза
Г крохмаль, так і целюлоза
Завдання 33 Укажіть один зі способів добування аніліну.
А дегідрування циклогексану
Б відновлення нітробензену
В гідрування метилбензену
Г гідроліз хлоробензену
Завдання 34 Укажіть назву речовини X у схемі перетворень
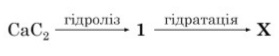
А етен
Б етан
В етанол
Г етаналь
Пояснення.
СaC2 + 2H2O → C2H2 + Ca(OH)2
C2H2 + H2O → CH3CHO
Завдання 35 У таблиці наведено значення розчинності речовин А – Д у воді за різних температур. Використавши дані таблиці, доповніть кожне речення 1–3 буквою А – Д так, щоб утворилося правильне твердження.
1 З підвищенням температури розчинність речовини Г зменшується.
2 За температури 40 oC в насиченому розчині речовини Б її маса більша, ніж маса розчинника.
3 Максимальна маса речовини А, яку можна розчинити у воді масою 150 г за температури 20oC, становить 47,4 г.
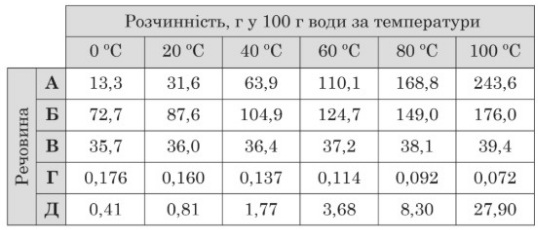
1-Г
2-Б
3-А
Пояснення.
Г 0,176>0,160>0,137>0,114>0,092>0,072
Б Маса розчинника 100 г, а за 200С маса розчиненої речовини 104,9 г > 100 г
А За умовою задачі:
у 150 г води за 200С розчинили 47,4 г
у 100 г води за 200С - х г
х = 47,4 г 100 г : 150 г = 31,6 г. За таблицею розчинності - речовина А
Завдання 36 У відповідніть клас органічних сполук 1–3 зі структурною формулою речовини А – Д, яка до нього належить.
1 альдегіди
2 феноли
3 спирти
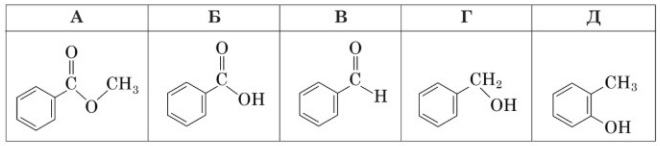
1-В
2-Д
3-Г
Завдання 37 Увідповідніть перетворення, номер якого позначено над стрілкою цифрою 1–3, з типом хімічної реакції А – Д.
![]()
А повне окиснення
Б відщеплення
В ізомеризація
Г приєднання
Д заміщення
1-Г
2-Д
3-Б
Завдання 38 У таблиці наведено формули органічних речовин А – Д. Доповніть кожне речення 1–3 буквою А – Д так, щоб утворилося правильне твердження.
1 Продуктом ізомеризації бутану є речовина Б .
2 З бромною водою реагує як речовина В, так і речовина Г .
3 Масова частка Карбону в речовині Г така сама, як і в речовині Д .
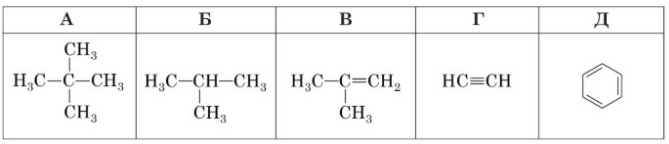
1-Б
2-Г
3-Д
Завдання 39 Обчисліть кількість речовини (моль) водню об’ємом 672 л (н.у.).
Відповідь: 30
Пояснення.
Віідомо: V(H2)=672 л
Знайти: n(H2)-?
Розв'язування
n(H2)=V(H2):VM=672 л : 22,4 л/моль=30 моль
Відповідь: 30 моль
Завдання 40 Обчисліть масу (г) купрум (ІІ) оксиду кількістю речовини 5 моль.
Відповідь: 400
Пояснення.
Віідомо: n(CuO)=5 моль
Знайти: m(CuO)-?
Розв'язування
M(CuO)=Ar(Сu)+Ar(O)=64+16=80, M(СuO)=80 г/моль
m(CuO)=n(CuO)•M(CuO)=5 моль•80 г/моль=400 г
Відповідь: 400 г
Завдання 41 Обчисліть об’єм (л) азоту (н.у.), у якому 3,01•1024 атомів Нітрогену. Уважайте, що NA=6,02•1023 моль–1.
Відповідь: 56
Пояснення.
Віідомо: N(N)=3,01•1024, NA=6,02•1023моль-1
Знайти: V(N2)-?
Розв'язування
І спосіб
n(N)=N(N):NA=3,01•1024: 6,02•1023моль-1=5 моль
У 1 моль молекул N2 міститься 2 моль атомів N, тому 1 моль атомів N буде міститися в 1/2 моль молекул N2, а 5 моль атомів N буде міститися в:
n(N2)=1/2•n(N)=5 моль:2=2,5 моль
V(N2)=v(N2)•VM=2,5 моль•22,4 л/моль=56 л
ІІ спосіб
1 моль азоту містить 6,02•1023 молекул N2 і займає за н.у. об'єм 22,4 л.
У 1 моль молекул N2 міститься 2 моль атомів N, тобто
12,04•1023 атомів N займають об'єм 22,4 л, а
3,01•1024 атомів N - x л.
За допомогою пропорції обчислюємо об'єм азоту.
12,04•1023 / 3,01•1024 = 22,4 / х
х • 12,04•1023 = 3,01•1024 • 22,4
х = 3,01•1024 • 22,4 : 12,04•1023
х = 56 л
Відповідь: 56 л
Завдання 42 У молекулі аскорбінової кислоти співвідношення мас атомів хімічних елементів таке: m(C):m(H):m(O)=9:1:12. Молярна маса цієї речовини в чотири рази більша за молярну масу пропану. Виведіть молекулярну формулу аскорбінової кислоти. У відповіді запишіть число, що дорівнює сумі індексів у виведеній формулі.
Відповідь: 20
Пояснення.
Відомо: m(C):m(H):m(O)=9:1:12, M(сполуки):M(C3H8)=4
Знайти: формулу сполуки-?
Розв'язування
M(С3Н8)=44 г/моль, M(С)=12 г/моль, М(Н)=1 г/моль, М(О)=16 г/моль
M(сполуки)=4•M(C3H8)=4•44=176 г/моль, маса 1 моль=176 г
У співвідношенні 9:1:12 разом 22 частини. Складаємо алгебраїчне рівняння і розв'язуємо його.
22 • х = 176
х = 176 : 22 = 8 г - маса, що припадає на одну частину, тому
m(C)=9•8=72 г
m(Н)=1•8=8 г
m(О)=12•8=96 г
n(C):n(H):n(O)=m(C)/M(C) : M(H)/M(H) : m(O)/M(O)=72/12 :8/1 : 96/16=6:8:6
Отже, формула сполуки С6Н8О6
6+8+6=20
Відповідь: 20
Завдання 43 Обчисліть відносну густину за воднем суміші метану з киснем, об’ємна частка кисню в якій становить 50%.
Відповідь: 12
Пояснення
відомо: суміш СН4 і О2, φ(О2)=50%, або 0,5
Знайти: DH2(суміші)-?
Розв'язування
φ(СН4)=1-φ(О2)=1-0,5=0,5
M(CH4)=16 г/моль, M(O2)=32 г/моль, М(Н2)=2 г/моль
Середню молярну масу суміші знаходимо за формулою:
М(суміші)=φ1•М1+φ2•М2, де φ1,φ2 -об'ємні частки компонентів газової суміші, М1,М2 - молярні маси компонентів суміші.
М(суміші)=φ(СН4)•М(СН4)+φ(О2)•М(О2)=0,5•16+0,5•32=24 г/моль
DH2(суміші)=M(суміші):М(Н2)=24 г/моль:2 г/моль=12
Відповідь: 12
Завдання 44 Глюкозу масою 60 г розчинили у воді, унаслідок чого утворився розчин масою 400 г. Обчисліть масову частку (%) глюкози в ньому.
Відповідь: 15
Пояснення.
Відомо: m(C6H12O6)=60 г, m(розчину)=400 г
Знайти: w(C6H12O6)-?
Розв'язування
w(C6H12O6)=m(C6H12O6):m(розчину)=60 г : 400 г=0,15, або 15%
Відповідь: 15%
Завдання 45 Обчисліть масу (г) води, з якою потрібно змішати натрій оксид масою 62 г, щоб утворився розчин натрій гідроксиду з масовою часткою лугу 25%.
Відповідь: 258
Пояснення.
Відомо: m(Na2O)=62 г, w(NaOH)=25%
Знайти: m(H2O)-?
Розв'язування
1. Складаємо хімічне рівняння:
62 г х г у г
Na2O + H2O = 2NaOH
62 г 18 г 80 г
M(Na2O)=62 г/моль, маса 1 моль=62 г
M(Н2O)=18 г/моль, маса 1 моль=18 г
M(NaOН)=40 г/моль, маса 1 моль=40 г, а маса 2 моль=80 г
2. За допомогою пропорції знаходимо масу NaOH і масу Н2О, що прореагували.
х=mпрореаг.(H2O)=62 г • 18 г : 62 г=18 г
у=m(NaOH)=62 г • 80 г : 62 г=80 г
3. Знаходимо масу розчину, що містить 25% NaOH.
m(розчину)=(m(NaOH):w(NaOH))•100%=(80 г:25%)•100%=320 г
4. Знаходимо масу води у 25% розчині NaOH.
m(H2O)=m(розчину)-m(NaOH)=320 г - 80 г = 240 г
5. Знаходимо масу води, що треба змішати.
m(H2O)=m(H2O)+mпрореаг.(H2O)=240 г + 18 г = 258 г
Відповідь: 258 г
Завдання 46 Використавши метод електронного балансу, перетворіть схему реакції
PbO2 + Mn(NO3)2 + HNO3 → HMnO4 + Pb(NO3)2 + H2O
на хімічне рівняння. Укажіть суму коефіцієнтів у цьому рівнянні.
Відповідь: 22
Пояснення.
Pb+4O2 + Mn+2(NO3)2 + HNO3 → HMn+7O4 + Pb+2(NO3)2 + H2O
Mn+2 -5e- → Mn+7 5|10|2 процес окиснення
Pb+4 +2e- → Pb+2 2| |5 процес відновлення
5PbO2 + 2Mn(NO3)2 + 6HNO3 → 2HMnO4 + 5Pb(NO3)2 + 2H2O
5+2+6+2+5+2=22
Завдання 47 На суміш масою 20 г, що складалася з магній оксиду й магній карбонату, подіяли хлоридною кислотою, узятою в надлишку. Унаслідок цього виділився газ об’ємом 2,24 л (н.у.). Обчисліть масову частку (%) магній карбонату в суміші.
Відповідь: 42
Пояснення.
Відомо: m(суміші)=20 г, V(СО2)=2,24 л
Знайти: w(MgCO3)-?
Розв'язування
І спосіб
У суміші сполук тільки магній карбонат реагує з кислотою з утворення газу.
1. Складаємо хімічне рівняння:
х г 2,24 л
MgCO3 + 2HCl = MgCl2 + CO2 + H2O
84 22,4 л
За н.у. 1 моль газу за н.у. займає об'єм 22,4 л.
M(MgCO3)=84 г/моль, маса 1 моль=84 г
2. За допомогою пропорції знаходимо масу магній карбонату.
х=m(MgCO3)=84 г • 2,24 л : 22,4 л=8,4 г
3. Масову частку сполуки в суміші обчислюємо за формулою:
w(сполуки)=m(сполуки)/m(суміші).
w(MgCO3)=m(MgCO3)/m(суміші)=8,4 г : 20 г=0,42, або 42%
ІІ спосіб
У суміші сполук тільки магній карбонат реагує з кислотою з утворення газу СО2.
1. v(CO2)=V(CO2):VM=2,24 л : 22,4 л/моль=0,1 моль
2. Складаємо хімічне рівняння: MgCO3 + 2HCl = MgCl2 + CO2 + H2O
За рівнянням реакції v(MgCO3):v(CO2)=1:1, кількість речовини однакова, тому
v(MgCO3)=v(CO2)=0,1 моль
M(MgCO3)=84 г/моль
m(MgCO3)=v(MgCO3)•M(MgCO3)=0,1 моль•84 г/моль=8,4 г
3. Масову частку сполуки в суміші обчислюємо за формулою:
w(сполуки)=m(сполуки)/m(суміші).
w(MgCO3)=m(MgCO3)/m(суміші)=8,4 г : 20 г=0,42, або 42%
Відповідь: 42%
Завдання 48 Один зі способів добування етанолу – каталітична гідратація етену. Обчисліть об’єм (л) етену (н.у.), потрібного для добування етанолу масою 184 г, якщо відносний вихід спирту становить 80%.
Відповідь: 112
Пояснення.
Відомо: mпракт.(С2Н5ОН)=184 г, η=80%
Знайти: V(C2H4)-?
Розв'язування
I спосіб
mтеор.(C2H5OH)=mпракт.(C2H5OH) : η • 100%=184 г : 80% • 100%=230 г
Записуємо рівняння реакції:
х л 230 г
C2H4 + H2O = C2H5OH
22,4 л 46 г
M(С2Н5ОН)=46 г/моль, маса 1 моль=46 г
За н.у. 1 моль газу займає об'єм 22,4 л
За допомогою пропорції обчислюємо об'єм етину.
х=V(C2H4)=230 г • 22,4 л : 46 г=112 л
IІ спосіб
mтеор.(C2H5OH)=mпракт.(C2H5OH) : η • 100%=184 г : 80% • 100%=230 г
M(С2Н5ОН)=46 г/моль
v(C2H5OH)=mтеор.(C2H5OH):M(C2H5OH)=230 г : 46 г/моль=5 моль
Записуємо рівняння реакції:
C2H4 + H2O = C2H5OH
За рівнянням реакції v(C2H4):v(C2H5OH)=1:1, тому
v(C2H4)=v(C2H5OH)=5 моль
V(C2H4)=v(C2H4)•VM=5 моль•22, л/моль=112 л
Відповідь: 112 л
Завдання 49 Газувата суміш складалася з азоту об’ємом 25 л та водню об’ємом 85 л. У закритій системі внаслідок реакції між ними утворився амоніак, відносний вихід якого становив 20%. Обчисліть об’ємну частку (%) азоту в газуватій суміші, що утворилася (об’єми газів виміряно за однакових умов).
Відповідь: 20
Пояснення.
Відомо: V(N2)=25 л; V(Н2)=85 л, η(NH3)=20%
Знайти: φ(N2)-?
Розв'язування
1. Складаємо хімічне рівняння реакції утворення амоніаку:
25 л х л у л
N2 + 3H2 ⇄ 2NH3
1 об'єм 3 об'єми 2 об'єми
x=V(H2)=25 л • 3 : 1=75 л
Для повної взаємодії 25 л N2 треба взяти Н2 об'ємом 75 л, а за умовою задачі його об'єм становить 85 л, тому ще залишиться водень об'ємом Vзалишок(H2)=85-75=10 л. Отже, водень — у надлишку, тому розрахунок теоретичного об'єму амоніаку здійснюємо за об'ємом азоту.
у=Vтеор.(NH3)=25 л • 2 : 1=50 л
Vпракт.(NH3)=Vтеор.(NH3) • η(NH3) : 100%=50 л • 20% : 100%=10 л
Система закрита, тому амоніак, що залишився, об'ємом 50-10=40 л буде розкладатися.
2. Складаємо хімічне рівняння реакції розкладу амоніаку:
40 л х л у л
2NН3 ⇄ N2 + 3H2
2 об'єми 1 об'єм 3 об'єми
x=V(N2)=40 л • 1 : 2=20 л
y=V(H2)=40 л • 3 : 2=60 л
3. Знаходимо об'єм суміші:
V(cуміші)=V(N2)+V(H2)+V(NH3)+Vзалишок(H2)=20 л + 60 л+ 10 л + 10 л=100 л
4. Об'ємну частку сполуки в суміші обчислюємо за формулою:
φ(сполуки)=(V(сполуки):V(суміші))•100%
φ(N2)=(V(N2):V(суміші))•100%=(20 л : 100 л) • 100%=20%
Відповідь: 20%
Завдання 50 Маса суміші карбонатів Кальцію та Магнію становила 9,2 г. Під час повного перетворення у водному розчині цих карбонатів на відповідні гідрогенкарбонати прореагував карбон (IV) оксид об’ємом 2,24 л (н.у.). Обчисліть масу (г) кальцій карбонату в суміші.
Відповідь: 5
Пояснення.
Відомо: m(CaCO3,MgCO3)=9,2 г; V(CO2)=2,24 л
Знайти: m(CaCO3)-?
Розв'язування
1. Приймаємо масу СаСО3 за х г, тоді маса MgCO3 дорівнює (9,2-x) г
2. Складаємо два хімічні рівняння:
|
х г V1 л СaCO3 + H2O + CO2 = Ca(HCO3)2 (1) 100 г 22,4 л |
|
(9,2 - х) г V2 л MgCO3 + H2O + CO2 = Mg(HCO3)2 (2) 84 г 22,4 л |
Над формулами сполук CaCO3 і MgCO3 записуємо маси (х г та (9,2 - х) г відповідно) і невідомі об'єми оксидів CO2, позначивши через змінні V1 i V2, (V1 л і V2 л відповідно), а під формулами - маси і об'єми кількості речовини згідно з коефіцієнтами в хімічному рівнянні. Для цього обчислюємо молярні маси (M=Mrг/моль) речовин й, відповідно, маси 1 моль, бо прореагувало 1 моль СaCO3 i 1 моль MgCO3 з 1 моль CO2 (1 моль газу за н.у. займає об'єм 22,4 л).
M(CaCO3)=100 г/моль, маса 1 моль=100 г
M(MgCO3)=84 г/моль, маса 1 моль=84 г
3. Записуємо дві пропорції та виводимо математичні вирази для мас речовин:
|
х / 100 = V1 / 22,4 V1 • 100 = x • 22,4 V1 = х • 22,4 : 100 m1 = 0,224 х |
9,2-x / 84 = V2 / 22,4 V2 • 84 = 22,4 • (9,2-x) m2 = 22,4 • (9,2-x) : 84
|
4. За умовою задачі об'єм суміші газів дорівнює 2,24 л, тому V1+V2=2,24
Підставимо в це рівняння отримані вирази для змінних V1 i V2 і розв'яжемо рівняння.
0,224 • х + 22,4 • (9,2-x) / 84 = 2,24
Зведемо до спільного знаменника: помножимо на 84, одержимо:
84 • 0,224 • х + 22,4 • (9,2-x) = 2,24 • 84
18,816 х + 206,08 - 22,4 х = 188,16
22,4 х - 18,816 х = 206,08 - 188,6
3,584 х = 17,48
х = 17,48 : 3,584
х = m(CaCO3)=5
Відповідь: 5 г
Завдання 51 Газувату суміш об’ємом 50 мл, що складалася з метану та етану, повністю спалили. Унаслідок цього утворився карбон (IV) оксид об’ємом 60 мл і вода. Обчисліть об’єм (мл) етану в газуватій суміші (об’єми газів виміряно за однакових умов).
Відповідь: 10
Пояснення.
Відомо: V(CH4,C2H6)=50 мл; V(CO2)=60 мл
Знайти: V(C2H6)-?
Розв'язування
1. Приймаємо об'єм метану за х мл, тоді об'єм етану рівний (50-x) мл
2. Складаємо два хімічні рівняння:
|
х мл V1 мл CH4 + 2O2 = CO2 + 2H2O (1) 22,4 мл 22,4 мл |
|
(50 - х) мл V2 мл 2C2H6 + 7O2 = 4CO2 + 6H2O (2) 44,8 мл 89,6 мл |
Над формулами сполук СН4 і C2Н6 записуємо об'єми (х мл та (50 - х) мл відповідно) і невідомі об'єми оксидів CO2, позначивши через змінні V1 i V2, (V1 мл і V2 мл відповідно), а під формулами - об'єми кількості речовини згідно з коефіцієнтами в хімічному рівнянні. За н.у. 1 ммоль газу займає об'єм 22,4 мл, 2 ммоль удвічі більший об'єм, тобто 44,8 мл, а 4 ммоль у 4 рази більший об'єм, тобто 89,6 мл.
3. Записуємо дві пропорції та виводимо математичні вирази для об'ємів газів:
|
х / 22,4 = V1 / 22,4 V1 • 22,4 = x • 22,4 V1 = х • 22,4 : 22,4 V1 = х
|
50-x / 44,8 = V2 / 89,6 V2 • 44,8 = 89,6 • (50-x) V2 = 89,6 • (50-x) : 44,8 V2 = 2 • (50-x) V2 = 100 - 2•х |
4. За умовою задачі об'єм суміші газів дорівнює 60 мл, тому V1+V2=60.
Підставимо в це рівняння отримані вирази для змінних V1 i V2 і розв'яжемо рівняння.
х + 100 - 2•x = 60
2x - x = 100 - 60
x = 40
Отже, V(CH4)=40 мл, а V(C2H6)=50-х=50-40=10 мл
Відповідь: 10 мл
Завдання 52 Газувату суміш вуглеводню об’ємом 10 мл та кисню об’ємом 60 мл підпалили. Після закінчення реакції та конденсування водяної пари утворилася газувата суміш об’ємом 50 мл, що складалася з карбон(IV) оксиду та кисню. Цю суміш пропустили крізь водний розчин лугу, узятого в надлишку. Унаслідок цього її об’єм зменшився до 30 мл (об’єми газів виміряно за однакових умов). Виведіть молекулярну формулу вуглеводню, у відповіді запишіть його відносну молекулярну масу.
Відповідь: 28
Пояснення.
Відомо: V(СхНу)=10 мл, V(O2)=60 мл, утворився Vзалиш.(O2,CO2)=50 мл, який зменшився до 30 мл після пропускання крізь NaOH
Знайти: CxHy -?
Розв'язування
У суміші газів СО2 і О2 з натрій гідроксидом реагує тільки СО2
Запишемо рівняння реакції:
2NaOH + CO2 -> Na2CO3 + H2O (1)
Після пропускання суміші газів СО2 і О2 крізь водний розчин натрій гідроксиду залишився кисень об'ємом Vзалиш.(О2)=30 мл і прореагував вуглекислий газ об'ємом V(CO2)=50-30=20 мл й, відповідно, стільки ж утворилося під час реакції горіння вуглеводню. Отже, в реакцію горіння вступив кисень об'ємом:
V(O2)=V(O2)-Vзалиш.(O2)=60-30=30 мл і утворився вуглекислий газ об'ємом V(CO2)=20 мл
Записуємо рівняння реакції горіння вуглеводню:
CxHy + O2 → CO2↑ + H2O (2)
Підставимо у рівняння (2) в якості коефіцієнтів знайдені об'ємні співвідношення (реагенти і продукти реакції є газоподібними речовинами), отримаємо:
10CxHy + 30O2 → 20CO2↑ + H2O або
CxHy + 3O2 → 2CO2↑ + H2O
За законом збереження маси речовин зрівняємо число атомів Оксигену до і після реакції:
CxHy + 3O2 → 2CO2↑ + 2H2O
Обчислюємо число атомів Карбону і Гідрогену у формулі вуглеводню:
х=2, у=4, отже, формула вуглеводню С2Н4
Mr(C2H4)=2Ar(C)+4Ar(H)=2•12+4=28
Відповідь: 28