Пригадаєте — використаєте
• 3 яких найменших частинок складаються речовини?
З атомів, молекулів та йонів.
• Який зміст терміна «хімічний елемент»?
Хімічний елемент — це певний вид атомів, що характеризується однаковим зарядом ядра (кількістю протонів).
• Як порівнюють атоми й молекули? За складом, розмірами, масою тощо.
Думаймо
1. Опишіть модель найпростішого атома.
Атом Гідрогену складається з позитивно зарядженого ядра із зарядом + 1 і негативно зарядженого електрона із зарядом –1, що рухається навколо нього.
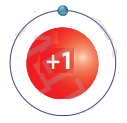
2. Про що свідчить таке твердження: якщо заряд ядра атома становить +1, то в атомі міститься один електрон, а якщо +2 — два електрони?
Таке твердження свідчить про те, що число протонів в ядрі атома дорівнює числу електронів в електронній оболонці атома, тому атом в цілому електронейтральний.
Розв'язуймо задачу
Маси атомів А і Б більші від 1/12 маси атома Карбону в 4 і 16 разів відповідно. Порівняйте маси атомів А і Б.
Розв'язання
Ar(C)=12, тому Ar(A)=12•4=48 і Ar(Б)=12•16=192, а їх відношення:
Ar(A) : Ar(Б)=192 : 48 = 4 (рази)
Відповідь: у 4 рази маса атома А більша від маси атома Б.
Виконаймо вправу
Округліть до цілих чисел значення відносних атомних мас Натрію, Купруму і Цинку, наведені в періодичній таблиці.
Ar(Na)=23, Ar(Cu)=64, Ar(Zn)=65
Відшукаймо
Назвіть кількість періодів і груп у періодичній таблиці (форзаци І і II).
У короткому варіанті періодичної таблиці 7 періодів, позначених від 1 до 7, і VIII груп, що поділяються на головні і побічні підгрупи, позначених римськими цифрами від I до VIII.
У довгому варіанті періодичної таблиці 7 періодів, позначених арабськими цифрами від 1 до 7, і 18 груп.
Виконаймо вправу
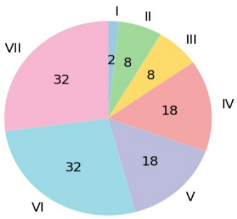
Створіть діаграму кількісного розподілу 118 хімічних елементів по періодах.
|
I |
II |
III | IV | V | VI | VII |
|
2 |
8 |
8 | 18 | 18 | 32 | 32 |
Думаймо
Назвіть заряди ядер атомів Гідрогену, Гелію, Карбону.
На величину заряду ядра атома вказує порядковий номер елемента в періодичній таблиці, тому заряд ядра атома Гідрогена +1, Гелію +2, Карбону +6.
Скільки електронів міститься в атомі кожного елемента?
Число електронів дорівнює числу протонів, а число протонів дорівнює порядковому номеру елемента в періодичній таблиці, тому в електронній оболонці атома Гідрогену міститься 1 електрон, Гелію — 2 електрони, Карбону — 6 електронів.
Думаймо
Прочитайте хімічні формули:
N2 — ен–два,
СО2 — це–о–два,
H2S — аш–два–ес,
Н3РO4 — аш–три–пе–о–чотири,
CO(NH2)2 — це–о–ен–аш–два–двічі.
Розв'язуймо задачу
Обчисліть відносні молекулярні маси кисню і метану СН4.
Mr(O2)=2Ar(O)=2•16=32
Mr(CH4)=Ar(C)+4Ar(H)=12+4•1=16
Думаймо
Атом якого хімічного елемента:
а) удвічі важчий за молекулу CO;
Mr(CO)=Ar(C)+Ar(O)=12+16=28, удвічі важча, тому 28•2 = 56, Ar(Fe)=56,
тому цим елементом є Ферум F.
б) у півтора раза легший за молекулу води?
Mr(H2O)=2Ar(H)+Ar(O)=2•1+16=18, у півтора рази менше, тому 28 : 1,5 = 12,
Ar(C)=12, тому цим елементом є Карбон C.
ВИОКРЕМЛЮЄМО ОСНОВНЕ
Проаналізувавши матеріал, викладений у параграфі, запишіть у зошиті висновки про найменші частинки речовин і хімічні елементи.
Найменшими частинками речовини є атоми, молекули та йони. Вид атомів із певним зарядом ядра називають хімічним елементом. Нині відомо 118 хімічних елементів. Найважливіша інформація про хімічні елементи є в періодичній таблиці.
Думаймо
Сформулюйте цікаве запитання за темою параграфа і поставте його своїм однокласникам/однокласницям.
У якому періоді періодичної таблиці розміщений хімічний елемент, відносна атомна маса якого в два рази більша за відносну атомну масу Кальцію?
Arr(Ca)=40, удвічі більша, тому 40•2=80, Ar(Br)=80, тому цим елементом є Бром Br, який розміщений у 4 періоді періодичної таблиці.
ВАШІ ДОСЯГНЕННЯ І ВІДКРИТТЯ
Вправа 1
Чому атом і молекула є електронейтральними частинками?
Атом електронейтральна частинка, бо кількість протонів і електронів однакова, тобто він не має заряду. Молекули складаються з електронейтральних атомів, тому також є електронейтральними частинками.
Вправа 2
Атоми можуть різнитися зарядами ядер, складом, масою.
Вправа 3
Випишіть з періодичної таблиці символи й назви елементів, заряди ядер атомів яких становлять +3, +5 і +9.
Li Літій, B Бор, F Флуор.
Вправа 4
Напишіть хімічні формули за їх вимовою:
о–три O3,
це–два–аш–пять–о–аш C2H5OH,
хром–два–ес–о–чотири–тричі Cr2(SO4)3,
ен–аш–чотири–двічі–це–о–три (NH4)2CO3.
Вправа 5
Що легше — 2 атоми Сульфуру чи 8 атомів Гелію? У скільки разів?
Відносна атомна маса Сульфуру Ar(S)=32, a двох атомів Сульфуру удвічі більша:
2•Ar(S) = 2 • 32 = 64
Відносна атомна маса Гелію Ar(He)=4, a восьми атомів Гелію у 8 рази більша:
8•Ar(He) = 8 • 4 = 32
А їхнє відношення: Ar(S):Ar(He) = 64 : 32 = 2
Відповідь: 8 атомів Гелію легші від 2 атомів Сульфуру в 2 рази.
Вправа 6*
Укажіть помилки у твердженні: Інертні гази — гелій, неон, аргон та ін. — перебувають у VIII групі періодичної таблиці та складаються з одноатомних молекул.
Інертні елементи — Гелій, Неон, Аргон та ін. — перебувають у VIII групі періодичної таблиці та складаються з одноатомних молекул.
Вправа 7
Відшукайте в періодичній таблиці хімічні елементи, якими утворена кухонна сіль, і запишіть у зошит інформацію про них.
Кухонна сіль утворена двома хімічними елементами: Na Натрій і Cl Хлор.
За матеріалами з інтернету з'ясували походження назв цих елементів.
Назва Натрій походить від арабського слова «натр» — сода.
Назва Хлор походить від грецького слова «хлорос» — зеленкуватий.
Вправа 8
На етикетках побутових хімікатів, мінеральних добрив, медичних препаратів, харчових продуктів знайдіть символи хімічних елементів або хімічні формули речовин і запишіть їх у зошит.
N — Натрій, P — Фосфор, K — Калій, (CH3)2CO — ацетон, H2SO4 — сульфатна кислота, HCl — хлоридна кислота, NH4NO3 — аміачна селітра, NaCl — кухонна сіль, NaHCO3 — харчова сода, Na2CO3 — кальцинована сода, CH3COOH — оцтова кислота, H2O — вода, CH3OH — метиловий спирт, C2H5OH — етиловий спирт, C8H8O3 — ванілін.
Вправа 9
Назвіть хімічний елемент, найпоширеніший:
а) в атмосфері; Нітроген N (близько 78% за об'ємом повітря)
б) у гідросфері; Гідроген H (міститься у складі молекули води)
в) у літосфері. Оксиген O (міститься в мінералах і гірських породах)
Вправа 10
Обчисліть відношення мас молекул:
а) амоніаку NH3 і сірководню H2S;
Mr(NH3)=Ar(N) + 3 • Ar(H) = 14 + 3 • 1 = 17
Mr(H2S)=2 • Ar(H) + Ar(S) = 2 • 1 + 32 = 34
Mr(NH3):Mr(H2S) = 17 : 34 = 0,5
Відповідь: відношення мас цих молекул дорівнює 0,5.
б) брому Вг2 і сірчистого газу SO2.
Mr(Br)= 2 • Ar(Br) = 2 • 80 = 160
Mr(SO2) = Ar(S)+2 • Ar(O) = 32 + 2 • 16 = 64
Mr(Br2):Mr(SO2) = 160 : 64 = 2,5
Відповідь: відношення мас цих молекул дорівнює 2,5.
Вправа 22
Створіть у зошиті таблицю оцінювання ваших знань і заповніть її.
| Навчальні досягнення (що я знаю та вмію) |
| Мені було легко зрозуміти з яких найменших частинок складаються речовини |
| Мені було важко зрозуміти різницю між атомом і хімічним елементом |
| Мені було цікаво як порівнюють атоми й молекули |