© 8next.com (відповіді, перероблене і доповнене)
Виконаймо вправу
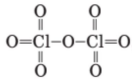
| Спрощена електронна формула | Графічна формула |
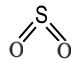 |
Допишіть значення валентності хімічних елементів у формулах сполук: SIVCl4, PBr5I, NI3I, CIVS2, P3N5III
Відповідь: SIVCl4I, PVBr5I, NIIII3I, CIVS2II, P3VN5III.
У сполуці SCl4 обчислюємо валентність усіх атомів Сульфуру (1•4=4) і ділимо на число атомів Хлору (4:4=1). Валентність Хлору — I.
У сполуці PBr5 обчислюємо валентність усіх атомів Брому (5•1=5) і ділимо на число атомів Фосфору (5:1=5). Валентність Фосфору — V.
У сполуці NI3 обчислюємо валентність усіх атомів Йоду (3•1=3) і ділимо на число атомів Нітрогену (3:1=3). Валентність Нітрогену — IІІ.
У сполуці CS2 обчислюємо валентність усіх атомів Карбону (4•1=4) і ділимо на число атомів Сульфуру (4:2=2). Валентність Сульфуру — IІ.
У сполуці P3N5 обчислюємо валентність усіх атомів Нітрогену (3•5=15) і ділимо на число атомів Фосфору (15:3=5). Валентність Фосфору — V.
У сполуці V2О5 валентність Оксигену — ІI. Обчислюємо валентність усіх атомів Оксигену (2•5=10) і ділимо на число атомів Ванадію (10:2=5). Валентність Ванадію — V.
У сполуці SiF4 валентність Флуору — І. Обчислюємо валентність усіх атомів Флуору (1•4=4) і ділимо на число атомів Силіцію (4:1=4). Валентність Силіцію — IV.
У сполукаці PH3 валентність Гідрогену — І. Oбчислюємо валентність усіх атомів Гідрогену (1•3=3) і ділимо на число атомів Фосфору (3:1=3). Валентність Фосфору — IІІ.
У сполуці H2Se валентність Гідрогену — І. Обчислюємо валентність усіх атомів Гідрогену (1•2=2) і ділимо на число атомів Селену (2:1=2). Валентність Селену — II.
У сполуці P2О3 валентність Оксигену — ІI. Обчислюємо валентність усіх атомів Оксигену (2•3=6) і ділимо на число атомів Фосфору (6:2=3). Валентність Фосфору — III.
У сполуці Mn2О7 валентність Оксигену — ІI. Обчислюємо валентність усіх атомів Оксигену (2•7=14) і ділимо на число атомів Мангану (14:2=7). Валентність Мангану — VII.
а) SiIV..H.., WVI..O.., O..F; Відповідь: SiH4, WO3, OF2.
Записуємо хімічні символи елементів, над ними позначаємо валентність елементів: SiIVHI. Найменше спільне кратне валентностей обох елементів дорівнює чотири (4•1=4). Отримане число ділимо на величину валентності кожного з елементів (4:4=1 i 4:1=4) — це індекси, які ставимо біля символу відповідного хімічного елемента (на письмі 1 не пишемо). Отже, формула SiH4.
Записуємо хімічні символи елементів, над ними позначаємо валентність елементів: WVIOII. Найменше спільне кратне валентностей обох елементів дорівнює шість. Отримане число ділимо на величину валентності кожного з елементів (6:6=1 i 6:2=3) — це індекси, які ставимо біля символу відповідного хімічного елемента (на письмі 1 не пишемо). Отже, формула WO3.
Записуємо хімічні символи елементів, над ними позначаємо валентність елементів: OIIFІ. Найменше спільне кратне валентностей обох елементів дорівнює два (2•1=2). Отримане число ділимо на величину валентності кожного з елементів (2:2=1 i 2:1=2) — це індекси, які ставимо біля символу відповідного хімічного елемента (на письмі 1 не пишемо). Отже, формула OF2.
б) NIII..O..,PV..O..,CIV..Cl... Відповідь: N2O3, P2O5, CCl4.
Записуємо хімічні символи елементів, над ними позначаємо валентність елементів: NIIIOІI. Найменше спільне кратне валентностей обох елементів дорівнює шість (3•2=6). Отримане число ділимо на величину валентності кожного з елементів (6:3=2 i 6:2=3) — це індекси, які ставимо біля символу відповідного хімічного елемента. Отже, формула N2O3.
Записуємо хімічні символи елементів, над ними позначаємо валентність елементів: PVOІI. Найменше спільне кратне валентностей обох елементів дорівнює десять (5•2=10). Отримане число ділимо на величину валентності кожного з елементів (10:5=2 i 10:2=5) — це індекси, які ставимо біля символу відповідного хімічного елемента. Отже, формула P2O5.
Записуємо хімічні символи елементів, над ними позначаємо валентність елементів: CIVClI. Найменше спільне кратне валентностей обох елементів дорівнює чотири (4•1=4). Отримане число ділимо на величину валентності кожного з елементів (4:4=1 i 4:1=4) — це індекси, які ставимо біля символу відповідного хімічного елемента (на письмі 1 не пишемо). Отже, формула ССl4.
|
Графічна формула |
H–N=C=S |
|
|
|
Валентність елементів
|
H (I) N (III) C (IV) S (II) |
Cl (VII) O (II)
|
H (I) O (II) Se (IV)
|
––––––––– ПРОГРАМА 2021 року ––––––––––
§8 ПЕРІОДИЧНИЙ ЗАКОН І ЕЛЕКТРОННА БУДОВА АТОМІВ
Вправа 46
Поступово чи періодично змінюється зі зростанням порядкового номера елемента:
а) загальна кількість електронів в атомі? Поступово
б) кількість електронів на зовнішньому енергетичному рівні? Періодично
Вправа 47
Випишіть у стовпчик усі символи елементів, що починаються з літери N. Після кожного символу вкажіть назву і тип відповідного елемента (s-, р-, d- чи f-елемент).
| Символ | Назва | Тип елемента |
|
N Ne Na Ni Nb Nd Np No |
Нітроген Неон Натрій Нікель Ніобій Неодим Нептуній Нобелій |
p-елемент p-елемент s-елемент d-елемент d-елемент f-елемент f-елемент f-елемент |
Клітинки елементів у періодичній системі мають певний колір — рожевий (s-елементи), жовтий (р-елементи), синій (d-елементи), зелений (f-елементи).
Вправа 48
Елементам яких типів належать такі електронні формули атомів:
а) 1s22s22p63s2; s-елемент
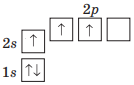
б) 1s22s22p1; p-елемент
в) 1s22s22p63s23p4? p-елемент
Назва орбіталі, що заповнюється останньою, визначає назву електрона (елемента).
Вправа 49
Не складаючи електронних формул, укажіть кількість електронів на останньому енергетичному рівні в атомах:
Cl — сім
Pb — чотири
As — п'ять
Кг — вісім
Номер групи, в якій міститься елемент, для елементів головних підгруп вказує на кількість електронів на останньому енергетичному рівні.
Вправа 50 Назвіть кілька хімічних елементів, максимальне значення валентності яких дорівнює 7.
Елементи VII групи: Хлор, Бром, Йод (окрім Флуору)
Вправа 51
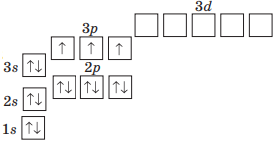
Укажіть можливі значення валентності хімічного елемента, якщо електронна формула його атома:
а) 1s22s22p63s23p3
Можлива валентність III і вища валентність V елемента Фосфора, що розміщується в V групі головній підгрупі Періодичної системи.
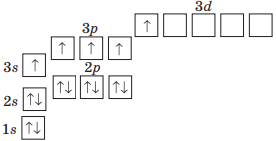
б) [Ne]3s23p5
Можливі валентності I, III, V і вища валентність VII елемента Хлор, що розміщується в VII групі головній підгрупі Періодичної системи.