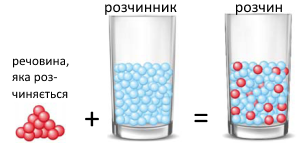
РОЗЧИН — цілком однорідна суміш з двох, або більше речовин.
Розчинник — рідина, яка розчиняє речовини (вода, ацетон, бензин, спирт).
Вода — універсальний розчинник, найпоширеніший розчинник на Землі, здатна розчиняти рідкі, тверді, газоподібні речовини, а утворена суміш речовин набуває одного з водою агрегатного стану.
Розчинена речовина — речовина, яка розчиняється, може змінити агрегатний стан.
Розчини за кількістю розчиненої речовини:
• розбавлені (мало розчиненої речовини);
• концентровані (багато розчиненої речовини).
Розчини за агрегатним станом:
• газуваті (суміш газів, наприклад, повітря);
• рідкі (розчини цукру, солі, спирту у воді);
• тверді (сплави сталі, нікелю в міді, міді в золоті, срібла в золоті).
Властивості рідкого розчину:
• текучість, збереження об’єму (властивості рідини-розчинника);
• набуває властивостей речовини (смаку, кольору тощо), яка розчинилася.
МАСА РОЗЧИНУ = Маса розчинника + Маса розчинної речовини.
На відміну від інших речовин Землі, маса води дорівнює об’єму:
• 100 мл = 100 г
• 1 л = 1 кг.
ГОТУЄМО РОЗЧИНИ
ДОСЛІД. Розчинення речовини у воді.
Розчинник змішують з речовиною, яка розчиняється, і отримують розчин.
У розчинах молекули одної речовини рівномірно розміщені між молекулами іншої речовини.

РОЗЧИНЕННЯ — процес переходу речовини, яка розчиняється, у товщу розчинника.
Модель явища розчинення
Речовина, що розчиняється, розпадається на молекули. Частинки рідини розташовані щільно, але хаотично, вони безперервно рухаються, час від часу міняються місцями.
Молекули речовини, що розчиняється, перемішуються з молекулами розчинника.
ДОСЛІД.
Розчинення кухонної солі у воді.
Знадобиться прозора скляна посудина, фільтр, столова ложка, сіль, вода.
Візьмемо одну ложку кухонної солі (близько 30 г), помістимо в посудину і додамо до неї 100 мл води. Ретельно перемішаємо, доки вся сіль не розчиниться. Маємо водний розчин солі, вода – розчинник, сіль – розчинена речовина. Пропустимо розчин крізь паперовий фільтр: розчин вільно пройшов крізь фільтр, нічого на ньому не залишивши.
ДОСЛІД.
Розчинення цукру у воді.
Знадобиться прозора скляна посудина, столова ложка, цукор, вода.
Візьмемо одну ложку цукру, помістимо в посудину і додамо до неї 100 мл води. Ретельно перемішаємо, доки весь цукор не розчиниться. Увесь цукор також розчиниться і навіть швидше, ніж сіль. Маємо водний розчин цукру, вода – розчинник, цукор – розчинена речовина.
ПОДІЛ РЕЧОВИН ЗА РОЗЧИННІСТЮ: розчинні, малорозчинні та нерозчинні.
Розчинність — це здатність речовини утворювати з іншою речовиною розчин.
Розчинні речовини — речовини, які розчиняються у розчиннику. Частинки таких речовин стають невидимими у розчині, вода не буде каламутною, на фільтрі не затримаються частинки. При звичайній температурі розчинність більша 1 г.
Вода набуває смаку, кольору речовини, яка в ній розчинилася.
Розчинні речовини: цукор, лимонна кислота, сода, акварельна фарба, оцтова кислота, кисень, вуглекислий газ, цемент, кухонна сіль.
У кожному літрі морської води розчинено в середньому 34 г різних солей, вона має солонувато-гіркий смак.
Малорозчинні речовини: глина, кальцієва сіль, гашене вапно. При звичайній температурі розчинність менша 1 г. Вода не буде дуже каламутною, але на фільтрі залишиться осад.
Нерозчинні речовини — речовини, які не розчиняються у воді. Частинки таких речовин зависають у воді, роблять воду каламутною і з часом осідають на дно, вони затримуються на фільтрі. При звичайній температурі розчинність менша 0,01 г.
Нерозчинні речовини: пісок, крейда, крохмаль, борошно, олія, ошурки, тирса, метали, спирт, бензин, нафта.
Абсолютно нерозчинних речовин у воді не існує.
Випивши чашку чаю, ми поглинаємо одну десятитисячну грама скла, бо вода – чудовий розчинник.
У морській воді розчинено понад 70 хімічних елементів.
Якби виділити розчинене в океані золото, то кожній людині на Землі дісталося би 3 кг.
Речовини, які розчиняються у воді, можуть не розчинятися в інших рідинах:
• сіль розчиняється у воді, але не розчиняється у олії.
Деякі речовини, які не розчиняються у воді, але розчиняються в інших розчинниках:
• жир (олія) не розчиняється у воді, але розчиняється у спирті, бензині, ацетоні, неполярних розчинниках (бензол, гексан, октан);
• парафін не розчиняється у воді та спирті, але розчиняється у бензині.
Швидкість розчинення можна збільшити.
• Подрібнити речовину, яка розчиняється.
Прискорює розпад речовини на частинки, дрібні частинки розчиняються швидше.
Тверду речовину можна змолоти, наприклад, цукрова пудра розчиняється швидше, ніж кристалічний цукор.
• Помішати суміш.
Прискорює змішування речовин, збільшується швидкість розчинення.
• Нагріти суміш.
Збільшиться кінетична швидкість частинок для перемішування, речовина швидше розпадеться на частинки, які проникатимуть між молекули розчинника.
Тверді речовини краще розчиняються в теплому розчиннику.
Розчинність газів з підвищенням температури зменшується
• Для газів збільшення тиску.
Чим більший тиск, тим більша розчинність газів, причому залежність прямо пропорційна.
Виготовлення газованих напоїв відбувається під тиском.
Чинники, які впливають на розчинення:
• будова речовини, яка розчиняється, та розчинника;
• температура розчинника;
• насиченість розчину;
• помішування;
• ступінь подрібнення;
• для розчинення газів – тиск.
НАСИЧЕНІСТЬ — кількісний склад розчину, за якого він стане насиченим за певних умов (межа розчинення речовини).
У воді не можна розчинити будь-яку кількість солі, цукру чи іншої речовини, адже під час додавання речовини у процесі розчинення настає момент, коли речовина перестає розчинятися. Додавання ще речовини, робить її надлишковою у розчині, а розчин перенасиченим.

Коефіцієнт розчинності — найбільша маса речовини, яка може за певних умов розчинитися у 100 г розчинника.
Коефіцієнт розчинності кухонної солі за кімнатної температури – 36 г.
ДОСЛІД.
Насиченість розчину.
Знадобиться дві прозорі скляні посудини, дві столові ложки, сіль, цукор, вода.
Помістимо одну ложку кухонної солі (30 г) у першу посудину і додамо до неї 100 мл води. Помістимо другу ложку цукру у другу посудину і додамо до неї 100 мл води. Ретельно перемішаємо. Маємо водний розчин солі та водний розчин цукру.

Додамо у посудини ще по 30 г відповідних речовин. Після ретельного розмішування бачимо, що цукор розчинився повністю, а сіль не вся. Отже, речовини розчиняються у воді не в будь-якій кількості, а лише до певних меж. Розчин цукру – ненасичений, а солі – перенасичений.
Розчини за розчиненням:
• насичені (стільки розчиненої речовини, що вона перестала розчинятися);
• ненасичені (розчинена речовина ще розчиняється).
Насичений розчин — розчин, у якому розчинено так багато речовини, що більше розчинитися не може за даної температури.
Ненасичений розчин — розчин, у якому речовина ще може розчинятися за даної температури.
Розчинні речовини, які змішуються з водою у будь-яких співвідношеннях: спирт, ацетон, сульфатна кислота, нітратна кислота.
Що вища температура розчинника, то більше речовини він розчиняє (для твердих і рідких розчинів).
Якщо підігріти насичений твердий або рідкий розчин, то додаткові порції речовини знову почнуть розчинятися до певного моменту, поки розчин знову не стане насиченим.
Розділення розчину (однорідної суміші) — спосіб випарювання, кристалізації, дистиляції.
Розчини в житті людини
• розчиняють цукор, щоб напитки та страви були солодкими;
• розчиняють сіль, щоб страва була солона;
• морську воду використовують для ванн;
• приготування гарячого шоколаду;
• вода розчиняє бруд, коли мити руки;
• газована вода, соки, маринади, столовий оцет — це також розчини;
• вода – універсальний розчинник;
• розчиняють пральний порошок у воді;
• фізіологічні розчини людини забезпечують життєдіяльність організмів;
• готують компот, сік, заварюють чай, використовують питну воду;
• бензином чистять жирні плями;
• миють посуд засобом для брудного посуду;
• розводять добриво з водою для підливу вазонів;
• користуються рідким милом, шампунем;
• використовують інші розчини побутової хімії;
• лікуються аптечними мікстурами.
Природні розчини неживої природи: вода океанів, морів, річок, озер, підземні води, джерельна вода.
Природні розчини живої природи:, фізіологічний розчин, розчини мінеральних речовин, кров, лімфа.
Розчини у природі: сік дерев, травний сік, слина, сеча, сльози, піт, кров, дощ, плазма, цитоплазма, лімфа, соки у вакуолях рослин, .
Розчини у побуті: соки, маринади, сиропи, мікстури, чай, перекис водню, зеленка, йод, спирт, оцет, ацетон, газовані напої, нашатирний спирт.